Hvorfor er der kun love for gasser og ikke faste stoffer eller væsker?
love for gasser
* Ideel gaslov: Dette er en grundlæggende lov, der vedrører tryk, volumen, temperatur og antallet af mol af en gas. Det fungerer godt for gasser under visse betingelser og er vidt brugt i kemi og fysik.
* Boyle's lov: Denne lov siger, at volumen af en gas er omvendt proportional med dens tryk ved en konstant temperatur.
* Charles 'lov: Denne lov siger, at volumen af en gas er direkte proportional med dens absolutte temperatur ved konstant tryk.
* Gay-Lussacs lov: Denne lov siger, at trykket fra en gas er direkte proportionalt med dens absolutte temperatur ved konstant volumen.
* Daltons lov om delvis pres: Denne lov siger, at det samlede tryk for en blanding af gasser er lig med summen af det delvise tryk på hver enkelt gas.
love for væsker og faste stoffer
* Lover om termodynamik: Disse love gælder for alle stoffer, herunder faste stoffer, væsker og gasser. De beskriver forholdet mellem varme, arbejde og intern energi.
* faseovergange: Der er love, der regulerer forholdene, under hvilke stoffer overgår mellem faste, væske og gasformige tilstande (f.eks. Meltedskab, kogepunkt).
* Viskositet og overfladespænding: Disse egenskaber er vigtige for at beskrive væskernes opførsel.
* Elasticitet og styrke: Disse egenskaber er afgørende for at forstå opførelsen af faste stoffer.
Hvorfor gaslove er mere specifikke
Gasser er unikke, idet deres molekyler er langt fra hinanden og har svage interaktioner sammenlignet med faste stoffer og væsker. Dette gør det muligt for gasser at:
* Udvid og kontrakt: Gasser er meget komprimerbare, hvilket betyder, at deres volumen kan ændre sig dramatisk med tryk.
* Fyld deres beholder: Gasser har ingen fast form og vil udvide sig til at fylde volumenet på deres beholder.
* Bland let let: Gasmolekyler kan bevæge sig frit og blandes let med andre gasser.
Disse egenskaber gør det lettere at definere og studere gassens opførsel ved hjælp af enkle, kvantificerbare forhold (som gaslovene).
Kortfattet
Mens vi ofte tænker på "gaslovgivning", er der love, der regulerer opførelsen af alle tilstande. Gaslovene er mere specifikke, fordi gassens egenskaber gør dem lettere at studere og modellere matematisk.
Sidste artikelHvorfor fik fluoratomet for at få en valenselektron?
Næste artikelEn forbindelse, der består af positive og negative ioner?
 Varme artikler
Varme artikler
-
 Genovervejelse af skadeproduktion og strålingsblanding i materialerTil venstre:Illustration af antallet af defekter i materialer forudsagt af den gamle Kinchin-Pease-ligning; Til højre:Illustration af det faktiske antal resterende skader, i overensstemmelse med forud
Genovervejelse af skadeproduktion og strålingsblanding i materialerTil venstre:Illustration af antallet af defekter i materialer forudsagt af den gamle Kinchin-Pease-ligning; Til højre:Illustration af det faktiske antal resterende skader, i overensstemmelse med forud -
 Forskere designer organisk katode til højtydende batterierHovedforfatter Zulipiya Shadike (til højre) er afbilledet ved NSLS-IIs XPD-strålelinje sammen med videnskabsmand og medforfatter Sanjit Ghose (til venstre). Kredit:Brookhaven National Laboratory F
Forskere designer organisk katode til højtydende batterierHovedforfatter Zulipiya Shadike (til højre) er afbilledet ved NSLS-IIs XPD-strålelinje sammen med videnskabsmand og medforfatter Sanjit Ghose (til venstre). Kredit:Brookhaven National Laboratory F -
 Hvad er det hvide på min påskechokolade, og kan jeg stadig spise det?Kredit:Shutterstock Ordene chokolade og skuffelse går ikke ofte sammen. Men du har måske oplevet en vis skuffelse, hvis du nogensinde har pakket den lyse folie af et påskeæg ud for at opdage hvid,
Hvad er det hvide på min påskechokolade, og kan jeg stadig spise det?Kredit:Shutterstock Ordene chokolade og skuffelse går ikke ofte sammen. Men du har måske oplevet en vis skuffelse, hvis du nogensinde har pakket den lyse folie af et påskeæg ud for at opdage hvid, -
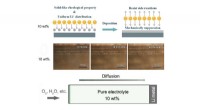 Hydrofob silica kolloid elektrolyt lover sikrere lithium-oxygen batterierSkematisk graf og eksperimentelle data, der viser den lithiumdendritforebyggende effekt af 10 vægt% HSCE. Skematisk graf og eksperimentelle data, der viser antikorrosionseffekten af 10 vægt% HSCE. K
Hydrofob silica kolloid elektrolyt lover sikrere lithium-oxygen batterierSkematisk graf og eksperimentelle data, der viser den lithiumdendritforebyggende effekt af 10 vægt% HSCE. Skematisk graf og eksperimentelle data, der viser antikorrosionseffekten af 10 vægt% HSCE. K


