Hvorfor fik fluoratomet for at få en valenselektron?
Her er grunden til, at fluor ønsker at få et elektron:
* stabilitet: Atomer er mest stabile, når deres yderste elektronskal (Valence Shell) er fuld.
* fluorens elektronkonfiguration: Fluor har 9 elektroner:2 i den første skal og 7 i den anden. For at have en fuld ydre skal, har den brug for 8 elektroner.
* At få en elektron: Ved at få en elektron opnår fluor en fuld ydre skal og bliver en fluorion ion (F-). Denne konfiguration er mere stabil og energisk gunstig.
Tænk på det sådan:Fluor er som et puslespil med et manglende hjørne. Ved at få et elektron afslutter det puslespillet og bliver et stabilt, komplet stykke.
 Varme artikler
Varme artikler
-
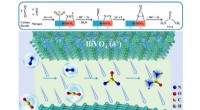 Nye katalysatorer forbedrer effektiviteten af urinstofsyntese ved omgivende betingelserDen skematiske elektrokatalytiske ureasyntesemekanisme baseret på Bi-BiVO 4 Mott-Schottky heterostruktur synergistiske effekter Kredit:Zhang Guangjin og Yuan Menglei Konvertering af både nitroge
Nye katalysatorer forbedrer effektiviteten af urinstofsyntese ved omgivende betingelserDen skematiske elektrokatalytiske ureasyntesemekanisme baseret på Bi-BiVO 4 Mott-Schottky heterostruktur synergistiske effekter Kredit:Zhang Guangjin og Yuan Menglei Konvertering af både nitroge -
 Stabiliserende egenskaber af grangummi kan justeres ved hjælp af ekstraktionsteknikkerFra højre:urenset grangummi opnået fra varmtvandsudvinding, grangummi opnået fra industristrømme, og renset grangummi. Kredit:Helsinki Universitet Biomasse opnået fra træ og de fraktioner, der udv
Stabiliserende egenskaber af grangummi kan justeres ved hjælp af ekstraktionsteknikkerFra højre:urenset grangummi opnået fra varmtvandsudvinding, grangummi opnået fra industristrømme, og renset grangummi. Kredit:Helsinki Universitet Biomasse opnået fra træ og de fraktioner, der udv -
 Voks på, smelte afForskere fra Drexel University, Purdue University og Oregon State University har opdaget, at tilsætning af paraffinolie til blandingen til vejbeton kan give den evnen til at smelte is og sne, når temp
Voks på, smelte afForskere fra Drexel University, Purdue University og Oregon State University har opdaget, at tilsætning af paraffinolie til blandingen til vejbeton kan give den evnen til at smelte is og sne, når temp -
 Svamp som lyddæmper3D-udskrivning af en prøve baseret på mycelium. Kredit:Fraunhofer UMSICHT Så sund og velsmagende som svampe kan være, de er gode til meget mere end bare middagsfadet. Fraunhofer Institut for Miljø
Svamp som lyddæmper3D-udskrivning af en prøve baseret på mycelium. Kredit:Fraunhofer UMSICHT Så sund og velsmagende som svampe kan være, de er gode til meget mere end bare middagsfadet. Fraunhofer Institut for Miljø
- Undersøgelse kaster lys over, hvordan antibiotikum 'Velcro' dræber bakterier
- Hvad bevæger ilt og næringsstoffer til cellerne?
- Hvordan producerer neuron energi?
- Producerer Nebulae mere end en stjerne?
- Teorier forudsiger 2D nanofluidkanaler, der viser ikke-lineær ledningsfunktion som hukommelseseffek…
- Atomvægten af kalium er 39,1 Ud fra dette kunne man korrekt konkludere, at?


