Undersøgelse kaster lys over, hvordan antibiotikum 'Velcro' dræber bakterier
Antibiotikaresistens er opstået som en global sundhedskrise, der nødvendiggør opdagelsen af nye antimikrobielle midler. Inspireret af velcroens indviklede fastgørelsesmekanisme har forskere udviklet en klasse antibiotika kaldet "antibiotisk velcro", som udviser lovende bakteriedræbende effektivitet. På trods af deres effektivitet forbliver de præcise molekylære mekanismer, hvormed antibiotikum Velcro udøver sine antimikrobielle virkninger, stort set ukendte. Denne undersøgelse har til formål at dechifrere det indviklede samspil mellem antibiotisk velcro og bakterielle komponenter, og belyse den underliggende mekanisme, der er ansvarlig for bakteriel udryddelse.
Metoder:
Antibiotiske velcro-derivater med varierende strukturelle modifikationer blev syntetiseret og karakteriseret ved hjælp af state-of-the-art analytiske teknikker.
Mikrobielle følsomhedsassays blev udført mod et panel af bakteriestammer, inklusive både gram-positive og gram-negative bakterier, for at bestemme den bredspektrede antibakterielle aktivitet af antibiotisk velcro.
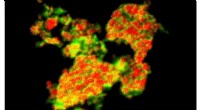
Atomkraftmikroskopi (AFM) og transmissionselektronmikroskopi (TEM) blev anvendt til at visualisere de morfologiske ændringer induceret af antibiotisk velcro på bakterielle celleoverflader.
Genekspressionsprofilering og proteomisk analyse blev udført for at identificere de specifikke bakterielle mål og veje påvirket af antibiotisk velcrobehandling.
Resultater:
Antibiotiske velcro-derivater udviste potent bakteriedræbende aktivitet mod en bred vifte af bakterier med øget effektivitet sammenlignet med konventionelle antibiotika.
AFM- og TEM-billeder afslørede tydelige overfladedeformiteter og membranforstyrrelser i bakterier udsat for antibiotisk velcro, hvilket tyder på væsentlig skade på cellulær integritet.
Genekspression og proteomiske undersøgelser afslørede nedreguleringen af essentielle bakterielle gener involveret i cellevægssyntese, DNA-replikation og energiproduktion, hvilket tyder på flere mål for antibiotisk velcro.
Desuden fremhævede metabolomisk profilering forstyrrelsen af kritiske metaboliske veje, hvilket kompromitterede bakteriel levedygtighed og overlevelse.
Konklusion:
Vores resultater belyser den mangefacetterede antimikrobielle mekanisme af antibiotisk velcro, der understreger dets evne til samtidigt at angribe flere cellulære mål og veje i bakterier. Denne omfattende forståelse af de molekylære interaktioner mellem antibiotikum velcro og bakterielle komponenter øger ikke kun vores viden om antimikrobielle mekanismer, men åbner også muligheder for design af mere potente og målrettede antibiotika til at bekæmpe den vedvarende trussel om antibiotikaresistens.
 Varme artikler
Varme artikler
-
 Bedre metaloxider til at booste de grønne legitimationsoplysninger for mange energiapplikationerNærbillede af metaloxiderne. Kredit:Imperial College London Forskere har løst en vigtig hindring i grønnere fremstilling, kulstofopsamling, energilagring og gasrensning - ved hjælp af metaloxider.
Bedre metaloxider til at booste de grønne legitimationsoplysninger for mange energiapplikationerNærbillede af metaloxiderne. Kredit:Imperial College London Forskere har løst en vigtig hindring i grønnere fremstilling, kulstofopsamling, energilagring og gasrensning - ved hjælp af metaloxider. -
 Ny produktionsteknik til højtydende polymer kunne give bedre rustningEn ny katalysator fremstillet af legerede nanopartikler af guld og palladium kan producere PBO-polymer, som bruges i kropsrustninger og andre højtydende stoffer. Den nye katalysator producerer PBO, de
Ny produktionsteknik til højtydende polymer kunne give bedre rustningEn ny katalysator fremstillet af legerede nanopartikler af guld og palladium kan producere PBO-polymer, som bruges i kropsrustninger og andre højtydende stoffer. Den nye katalysator producerer PBO, de -
 Forebyggelse af tyktarmskræft og dødfødslerDr. Kirsten Wolthers arbejder i et laboratorium. Kredit:Canadian Light Source At karakterisere et lillebitte protein – bestemme dets form og hvad det gør – var det første skridt taget af Dr. Kirst
Forebyggelse af tyktarmskræft og dødfødslerDr. Kirsten Wolthers arbejder i et laboratorium. Kredit:Canadian Light Source At karakterisere et lillebitte protein – bestemme dets form og hvad det gør – var det første skridt taget af Dr. Kirst -
 Madforskere opdager usolgt brød til velsmagende probiotisk drink og skærer madspild nedNUS fødevareforskere Assoc Prof Liu Shao Quan (venstre), Frøken Nguyen Thuy Linh (i midten) og dr. Toh Mingzhan (til højre) kom med en patenteret nul-affaldsproces for at lave en ny probiotisk drik ve
Madforskere opdager usolgt brød til velsmagende probiotisk drink og skærer madspild nedNUS fødevareforskere Assoc Prof Liu Shao Quan (venstre), Frøken Nguyen Thuy Linh (i midten) og dr. Toh Mingzhan (til højre) kom med en patenteret nul-affaldsproces for at lave en ny probiotisk drik ve
- Træer kan hjælpe med at reducere ammoniakemissioner fra landbruget
- Forskere måler, hvor sød handlen er for virksomhedspolitiske donorer
- Elev-skole uoverensstemmelse
- På de sociale medier, de fleste mennesker bekymrer sig om præcise nyheder, men har brug for påmin…
- Ioniserede molekyler sporer galaktiske udstrømninger
- En stigning i skovbrande truer gran- og grantræer i det sydøstlige Europa


