Hvorfor findes ioner med ladninger over 3 sjældent i ioniske forbindelser?
1. Elektrostatisk frastødelse: Efterhånden som ladningen på en ion øges, gør dens elektrostatiske tiltrækning også til modsat ladede ioner. Dette fører imidlertid også til øget frastødelse mellem ioner af samme ladning. Denne frastødelse gør det stadig vanskeligere at pakke ioner med høje ladninger sammen i en stabil krystalgitter.
2. Polarisering og kovalens: Højde ladede ioner har en tendens til at fordreje de nærliggende ioner, der fører til en grad af kovalent karakter i bindingen. Dette svækker bindingens ioniske karakter og gør det vanskeligere at opretholde et rent ionisk gitter.
3. Energiovervejelser: Dannelsen af stærkt ladede ioner kræver generelt en betydelig mængde energi for at fjerne eller tilføje flere elektroner. Denne energiomkostning kan gøre dannelsen af sådanne ioner energisk ugunstige.
4. Størrelseseffekter: Højt ladede ioner har en tendens til at være mindre end deres mindre ladede kolleger på grund af den stærke tiltrækning af kernen for de resterende elektroner. Denne mindre størrelse kan føre til betydelig frastødelse mellem ioner i et gitter, hvilket gør stabil krystaldannelse udfordrende.
5. Reaktivitet: Meget ladede ioner er ofte meget reaktive på grund af deres stærke elektrostatiske tiltrækning til modsat ladede arter. Denne reaktivitet gør dem mindre tilbøjelige til at danne stabile forbindelser under typiske forhold.
Undtagelser:
Mens ioner med anklager over 3 er usædvanlige, er der undtagelser. Nogle eksempler inkluderer:
* Overgangsmetaller: Overgangsmetaller kan danne ioner med ladninger op til +7, som det ses i permanganationen (MnO4-) og chromate ion (CRO4-2). Selv i disse tilfælde opnås de højere ladninger ofte i komplekse anioner med flere iltatomer.
* lanthanider og actinider: Disse elementer kan danne ioner med høje ladninger på grund af deres store størrelse og komplekse elektronkonfigurationer.
Sammenfattende gør kombinationen af elektrostatisk frastødning, polarisering, energiovervejelser, størrelseseffekter og reaktivitet det udfordrende for ioner med ladninger, der er over 3 til at danne stabile ioniske forbindelser.
Sidste artikelHvad kombineres fluor med?
Næste artikelHvad er formlen for elementært kulstof?
 Varme artikler
Varme artikler
-
 Gennembrud i sur vandelektrolyse via rutheniumbaserede katalysatorerIltudviklingsreaktion (OER) og oxygenreduktionsreaktion (ORR) kan betragtes som to trofæer inden for effektiv udnyttelse af brintenergi. Imidlertid, i sur OER, et stort anvendt potentiale var påkrævet
Gennembrud i sur vandelektrolyse via rutheniumbaserede katalysatorerIltudviklingsreaktion (OER) og oxygenreduktionsreaktion (ORR) kan betragtes som to trofæer inden for effektiv udnyttelse af brintenergi. Imidlertid, i sur OER, et stort anvendt potentiale var påkrævet -
 Designet til rumrejser, ny enhed kan indsamle, analysere væske, når den passerer planeterPurnendu Sandy Dasgupta, Hamish Small Chair i ionanalyse i UTA Institut for Kemi og Biokemi og adjungeret professor i afdelingerne for Fysik og Elektroteknik. Kredit:UTA En kemiker ved University
Designet til rumrejser, ny enhed kan indsamle, analysere væske, når den passerer planeterPurnendu Sandy Dasgupta, Hamish Small Chair i ionanalyse i UTA Institut for Kemi og Biokemi og adjungeret professor i afdelingerne for Fysik og Elektroteknik. Kredit:UTA En kemiker ved University -
 Mikrobiel brændselscelle omdanner metan til elektricitetTransmissionselektronmikroskopibillede fra Thomas Woods laboratorium af deres konstruerede M. acetivorans stammefangende metan. Kredit:Thomas Wood, Penn State Transport af metan fra gasbrøndhove
Mikrobiel brændselscelle omdanner metan til elektricitetTransmissionselektronmikroskopibillede fra Thomas Woods laboratorium af deres konstruerede M. acetivorans stammefangende metan. Kredit:Thomas Wood, Penn State Transport af metan fra gasbrøndhove -
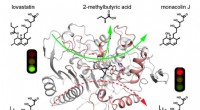 Forskere afslører den katalytiske mekanisme af lovastatinhydrolaseLovastatinhydrolase PcEST katalyserer specifikt og effektivt omdannelsen af lovastatin til monacolin J, men kan ikke hydrolysere simvastatin Kredit:LIANG Yajing Hyperlipidæmi, en af de mest al
Forskere afslører den katalytiske mekanisme af lovastatinhydrolaseLovastatinhydrolase PcEST katalyserer specifikt og effektivt omdannelsen af lovastatin til monacolin J, men kan ikke hydrolysere simvastatin Kredit:LIANG Yajing Hyperlipidæmi, en af de mest al


