Hvor mange gram chrom (III) chlorid kræves for at producere 75,0 g sølvchlorid?
1. Skriv den afbalancerede kemiske ligning:
Reaktionen mellem krom (III) chlorid (CRCL₃) og sølvnitrat (Agno₃) producerer sølvchlorid (AgCl) og chrom (III) nitrat (CR (NO₃) ₃).
Den afbalancerede ligning er:
CRCL₃ (aq) + 3agno₃ (aq) → 3Agcl (s) + cr (no₃) ₃ (aq)
2. Beregn de molære masser:
* CRCL₃:158,36 g/mol (52,00 g/mol Cr + 3 * 35,45 g/mol Cl)
* AGCl:143,32 g/mol (107,87 g/mol Ag + 35,45 g/mol Cl)
3. Brug støkiometri til at finde massen af CRCL₃:
* Trin 1:Konverter gram AGCL til mol:
75,0 g AgCl * (1 mol AgCl / 143,32 g AgCl) =0,523 mol AgCl
* Trin 2:Brug molforholdet fra den afbalancerede ligning:
0,523 mol AgCl * (1 mol crcl₃ / 3 mol AgCl) =0,174 mol crcl₃
* Trin 3:Konverter molen af CRCL₃ til gram:
0,174 mol crcl₃ * (158,36 g crcl₃ / 1 mol crcl₃) = 27,6 g crcl₃
Derfor kræves 27,6 gram krom (III) chlorid for at producere 75,0 gram sølvchlorid.
Sidste artikelHvad er det kemiske navn på H2O?
Næste artikelEr flydende plus luft et rent stof?
 Varme artikler
Varme artikler
-
 Jernbaserede solceller på vej til at blive mere effektiveKredit:CC0 Public Domain En international undersøgelse ledet fra Lunds Universitet i Sverige viser, at 30 procent af energien i en bestemt type lysabsorberende jernmolekyle forsvinder på en hidtil
Jernbaserede solceller på vej til at blive mere effektiveKredit:CC0 Public Domain En international undersøgelse ledet fra Lunds Universitet i Sverige viser, at 30 procent af energien i en bestemt type lysabsorberende jernmolekyle forsvinder på en hidtil -
 Grafenmembraner kan gøre atomindustrien grønnereKredit:University of Manchester Grafen kunne hjælpe med at reducere energiomkostningerne ved at producere tungt vand og dekontaminering i atomkraftværker med over hundrede gange sammenlignet med n
Grafenmembraner kan gøre atomindustrien grønnereKredit:University of Manchester Grafen kunne hjælpe med at reducere energiomkostningerne ved at producere tungt vand og dekontaminering i atomkraftværker med over hundrede gange sammenlignet med n -
 En radikal løsning kommer fra at blande værktøjerDen aktive art i den katalytiske reaktion, der kommer ud på den smeltede overflade af natriumwolframatet, er natriumperoxid. Gengivet med tilladelse fra reference. Kredit:Wiley-VCH Verlag GmbH &Co.
En radikal løsning kommer fra at blande værktøjerDen aktive art i den katalytiske reaktion, der kommer ud på den smeltede overflade af natriumwolframatet, er natriumperoxid. Gengivet med tilladelse fra reference. Kredit:Wiley-VCH Verlag GmbH &Co. -
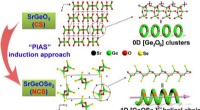 Ny delvis isovalent anionsubstitutionsinduktionsstrategi til design af infrarøde, ikke -lineære op…Strukturel transformation fra CS -forbindelse SrGeO3 til NCS SrGeOSe2. Kredit:Prof. ZHU’s Group Infrarøde ikke -lineære optiske (IR – NLO) materialer er afgørende for en bred vifte af applikatione
Ny delvis isovalent anionsubstitutionsinduktionsstrategi til design af infrarøde, ikke -lineære op…Strukturel transformation fra CS -forbindelse SrGeO3 til NCS SrGeOSe2. Kredit:Prof. ZHU’s Group Infrarøde ikke -lineære optiske (IR – NLO) materialer er afgørende for en bred vifte af applikatione
- 30 s til at gå fra 7 ms 54 Hvad er dens acceleration?
- Uddannelse er ikke en faktor for, hvornår kvinder i Afrika gifter sig
- Hvor mange joule energi i et kilo kul?
- Måler et bilhastighedsmåler hastigheden eller hastigheden af et objekt?
- Først på Mars -menuen:spuds
- Hvad er nogle spørgsmål, som du kan stille om sund energi?


