Et fast stof med en masse på 200 gram er ved sin smeltepunktstemperatur i kalorimeter, mens ændringerne fra til væske samme 400-gram vand?
For at løse dette har vi brug for lidt mere information. Her er en oversigt over, hvad der er nødvendigt:
1. Fusionsvarmen:
* Vi er nødt til at kende fusionsvarmen (også kaldet entalpi af fusion) for det faste stof. Dette er den mængde energi, der kræves for at smelte et gram af stoffet på dets smeltepunkt.
* Denne værdi måles typisk i joulesenheder pr. Gram (J/g).
2. De oprindelige og sidste temperaturer i vandet:
* Vi er nødt til at kende indledende temperatur af de 400 gram vand.
* Vi er også nødt til at kende endelige temperatur af vandet efter det faste stof smelter og når termisk ligevægt.
Her er, hvordan man nærmer sig problemet:
1.
* Multiplicer massen af det faste (200 gram) med dens fusionsvarme. Dette giver dig den samlede energi, der kræves for at smelte det faste stof.
2. Beregn den varme, der er absorberet af vandet:
* Den varme, der absorberes af vandet, er lig med den varme, der frigives af det smeltende faste stof.
* Brug formlen:Q =MCΔT, hvor:
* Q er den optagne varme (eller frigivet)
* m er massen af vandet (400 gram)
* C er den specifikke varmekapacitet af vand (ca. 4.184 J/g ° C)
* ΔT er ændringen i temperaturen på vandet (endelig temperatur - starttemperatur)
3. Løs for den endelige temperatur på vandet:
* Du får varmen absorberet af vandet fra trin 2. Tilslut de kendte værdier for masse, specifik varme og den første temperatur i formlen Q =MCΔT og løs for ΔT.
* Tilføj ΔT til den oprindelige temperatur på vandet for at finde den endelige temperatur.
Eksempel:
Lad os antage, at det faste stof er is, og dets fusionsvarme er 334 j/g. Lad os også sige, at den oprindelige temperatur på vandet er 20 ° C.
1.
* 200 gram * 334 j/g =66.800 j
2. Varme absorberet af vand:
* 66.800 J =400 gram * 4,184 J/g ° C * ΔT
3. Endelig temperatur på vand:
* ΔT =66.800 J / (400 gram * 4,184 J / g ° C) ≈ 39,9 ° C
* Endelig temperatur =20 ° C + 39,9 ° C ≈ 59,9 ° C
Husk: Dette er et forenklet eksempel. I situationer i den virkelige verden skal du redegøre for faktorer som varmetab til omgivelserne og den specifikke varmekapacitet i selve kalorimeteret.
 Varme artikler
Varme artikler
-
 Ny metode til isolering af tumorceller kan forbedre kræftforskning og -behandlingLeidong Mao (til venstre), en lektor ved UGA College of Engineering arbejdede sammen med ph.d.-studerende Wujun Zhao om at udvikle en ny enhed, der er i stand til at isolere tumorceller. Kredit:Univer
Ny metode til isolering af tumorceller kan forbedre kræftforskning og -behandlingLeidong Mao (til venstre), en lektor ved UGA College of Engineering arbejdede sammen med ph.d.-studerende Wujun Zhao om at udvikle en ny enhed, der er i stand til at isolere tumorceller. Kredit:Univer -
 Hvordan nye materialer øger effektiviteten af direkte ethanolbrændselscellerMaterialet består af Nafion med indlejrede nanopartikler. Kredit:B.Matos/IPEN Ethanol har fem gange højere volumetrisk energitæthed (6,7 kWh/L) end brint (1,3 kWh/L) og kan sikkert bruges i brænds
Hvordan nye materialer øger effektiviteten af direkte ethanolbrændselscellerMaterialet består af Nafion med indlejrede nanopartikler. Kredit:B.Matos/IPEN Ethanol har fem gange højere volumetrisk energitæthed (6,7 kWh/L) end brint (1,3 kWh/L) og kan sikkert bruges i brænds -
 Lys kan bruges til at kontrollere genfunktionenOptogenetics anvender metoder, hvor lys kan bruges til at styre cellulære funktioner. Kredit:Jari Rossi Lys kan bruges som en nøjagtig metode til at kontrollere genekspression, viser banebrydende
Lys kan bruges til at kontrollere genfunktionenOptogenetics anvender metoder, hvor lys kan bruges til at styre cellulære funktioner. Kredit:Jari Rossi Lys kan bruges som en nøjagtig metode til at kontrollere genekspression, viser banebrydende -
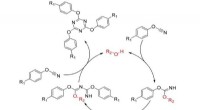 Kemikere tilbyder et nyt kig på polymerer til rumindustrienMekanisme for cyklotrimerisering af cyanatestere. Kredit:Kazan Federal University Medarbejdere ved Institut for Fysisk Kemi ved Kazan Federal University har fundet ud af, at mekanismerne til polym
Kemikere tilbyder et nyt kig på polymerer til rumindustrienMekanisme for cyklotrimerisering af cyanatestere. Kredit:Kazan Federal University Medarbejdere ved Institut for Fysisk Kemi ved Kazan Federal University har fundet ud af, at mekanismerne til polym
- Elbiler:Sådan kommer vi dertil
- Rockprøver bragt tilbage fra månen under det polære rumprogram, hvor ældre end klipper findes på…
- Skovens kroner:Indonesisk hjælper orkideer med at blomstre igen
- Hvad er syntetiske mineraler?
- Sådan beregnes ækvivalente enheder
- Forskere blander det ublandbare for at skabe chokerende nanopartikler


