Hvilket element er mere metallisk al eller li na mg?
Forståelse af metallisk karakter
Metallisk karakter henviser til, hvor let et element mister elektroner til dannelse af positive ioner (kationer). Elementer med stærk metallisk karakter er typisk:
* Gode ledere af varme og elektricitet
* Formbar (kan hamres i former)
* Duktil (kan trækkes ind i ledninger)
Tendenser i den periodiske tabel
Metallisk karakter øges generelt:
* ned en gruppe (kolonne): Elektroner er længere væk fra kernen, hvilket gør dem lettere at tabe.
* på tværs af en periode (række): Elektroner er tættere på kernen og oplever en stærkere attraktion, hvilket gør dem sværere at tabe.
analyse af elementerne
* li, na og mg er alle i henholdsvis gruppe 1 og 2. Dette betyder, at de alle er mere metalliske end aluminium (AL).
* li, na og mg Alle har lavere ioniseringsenergier end Al, hvilket betyder, at de mister elektroner lettere.
Konklusion
Ud af Al, Li, Na og Mg, Li, Na og Mg er mere metalliske end al.
specifikt:
* natrium (NA) er det mest metalliske element i denne gruppe, fordi det er længst nede i sin søjle og har den laveste ioniseringsenergi.
* lithium (Li) og magnesium (mg) Udstiller også stærk metallisk karakter.
Sidste artikelHvor mange molekyler i 3 mol ammoniak NH3?
Næste artikelHvad er den kemiske formel af kobber II perchlorat?
 Varme artikler
Varme artikler
-
 Overvågning af syntesen af bakteriecellevæggen i realtidKredit:CC0 Public Domain Et væsentligt gennembrud er netop blevet gjort i biokemiens verden:Et hold af internationale forskere har udviklet en revolutionerende metode til i realtid at overvåge et
Overvågning af syntesen af bakteriecellevæggen i realtidKredit:CC0 Public Domain Et væsentligt gennembrud er netop blevet gjort i biokemiens verden:Et hold af internationale forskere har udviklet en revolutionerende metode til i realtid at overvåge et -
 Ny stofbelægning kunne forhindre kemiske våben, redde livEn ny stofbelægning kunne neutralisere kemiske våben og hjælpe med at redde utallige liv. Kredit:American Chemical Society Kemiske våben er mareridtsagtige. På et millisekund, de kan dræbe hundred
Ny stofbelægning kunne forhindre kemiske våben, redde livEn ny stofbelægning kunne neutralisere kemiske våben og hjælpe med at redde utallige liv. Kredit:American Chemical Society Kemiske våben er mareridtsagtige. På et millisekund, de kan dræbe hundred -
 Forskere skaber smarte overflader for at hjælpe blodkartransplantationer til at strikke bedre, mere…McMaster University-forsker Tohid Didar, en mekanisk og biomedicinsk ingeniør, ledet et team, der har skabt en belægning for at gøre syntetiske vaskulære transplantater mindre tilbøjelige til infektio
Forskere skaber smarte overflader for at hjælpe blodkartransplantationer til at strikke bedre, mere…McMaster University-forsker Tohid Didar, en mekanisk og biomedicinsk ingeniør, ledet et team, der har skabt en belægning for at gøre syntetiske vaskulære transplantater mindre tilbøjelige til infektio -
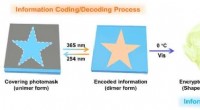 Ny fluorescerende organohydrogel foreslået for at opnå dobbelt informationskrypteringInformationskodning/dekodning og kryptering/dekryptering baseret på den fluorescerende organohydrogel. Kredit:NIMTE Smart Polymer Materials Group ledet af prof. Chen Tao ved Ningbo Institute of Mat
Ny fluorescerende organohydrogel foreslået for at opnå dobbelt informationskrypteringInformationskodning/dekodning og kryptering/dekryptering baseret på den fluorescerende organohydrogel. Kredit:NIMTE Smart Polymer Materials Group ledet af prof. Chen Tao ved Ningbo Institute of Mat
- Hvordan australske supercomputere knuste tallene for at guide vores bushbrand og pandemiske reaktion
- Sådan begrænses global opvarmning 1,5C
- Hvilket enzym nedbryder ris?
- Hvor lang tid ville det tage at få månen ved 55 mph?
- Kinesisk fotonisk kvantecomputer demonstrerer kvanteoverherredømme
- Ikke så dyrebart:Fjernelse af guld fra AFM-sonder giver bedre måling af picoskalakræfter


