Hvor mange mol ammoniumioner er i 6,965 g carbonat?
1. Bestem formlen for carbonatsalt
Du skal kende det specifikke carbonatsalt, du har at gøre med. For eksempel:
* natriumcarbonat (Na₂co₃): Dette ville være et forhold på 1:1 mellem carbonationer (co₃²⁻) og natriumioner (Na⁺)
* calciumcarbonat (caco₃): Dette ville være et forhold på 1:1 mellem carbonationer (co₃²⁻) og calciumioner (Ca²⁺)
2. Beregn den molære masse af carbonatsalt
* Slå op på atommasserne af hvert element i formlen (fra den periodiske tabel).
* Tilsæt atommasserne af alle atomer i formlen.
eksempel (ved hjælp af natriumcarbonat, Na₂co₃):
* NA:22,99 g/mol
* C:12,01 g/mol
* O:16,00 g/mol
* Molmasse Na₂co₃ =(2 * 22.99) + 12.01 + (3 * 16.00) =105,99 g/mol
3. Konverter gram til mol
* Opdel massen af carbonatsalt (6,965 g) med den molære masse, du beregnet i trin 2.
eksempel (ved hjælp af natriumcarbonat, Na₂co₃):
* Mol Na₂co₃ =6,965 g / 105,99 g / mol =0,0657 mol
4. Bestem forholdet mellem carbonationer og ammoniumioner
* Da du leder efter antallet af mol ammoniumioner (NH₄⁺), skal du kende formlen for salt, der indeholder ammonium og carbonat.
* Eksempel: Hvis saltet er ammoniumcarbonat ((NH₄) ₂CO₃), er forholdet 2:1 (to ammoniumioner for hver carbonation).
5. Beregn mol af ammoniumioner
* Multiplicer molen af carbonatsalt (fra trin 3) med forholdet mellem ammoniumioner og carbonationer (fra trin 4).
Eksempel (ved hjælp af ammoniumcarbonat, (NH₄) ₂CO₃):
* Mol NH₄⁺ =0,0657 mol na₂co₃ * (2 mol NH₄⁺ / 1 mol co₃²⁻) =0,1314 mol NH₄⁺
Vigtigt: Denne beregning antager, at du arbejder med et specifikt salt, der indeholder ammonium- og carbonationer. Hvis du ikke har leveret saltformlen, kan jeg ikke afslutte beregningen.
Sidste artikelHvor mange bindinger mellem ilt og brint i et hydroxidatom?
Næste artikelHvor kommer brintgas fra?
 Varme artikler
Varme artikler
-
 Genovervejelse af skadeproduktion og strålingsblanding i materialerTil venstre:Illustration af antallet af defekter i materialer forudsagt af den gamle Kinchin-Pease-ligning; Til højre:Illustration af det faktiske antal resterende skader, i overensstemmelse med forud
Genovervejelse af skadeproduktion og strålingsblanding i materialerTil venstre:Illustration af antallet af defekter i materialer forudsagt af den gamle Kinchin-Pease-ligning; Til højre:Illustration af det faktiske antal resterende skader, i overensstemmelse med forud -
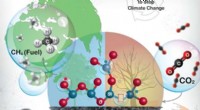 At lukke kulstofkredsløbet for at stoppe klimaforandringerneDefekter i nanosilica kan redde planeten jorden fra global opvarmning. Kredit:Ayan Maity, TIFR, Mumbai En for stor mængde kuldioxid er hovedårsagen til klimaændringer. En af de bedste metoder er a
At lukke kulstofkredsløbet for at stoppe klimaforandringerneDefekter i nanosilica kan redde planeten jorden fra global opvarmning. Kredit:Ayan Maity, TIFR, Mumbai En for stor mængde kuldioxid er hovedårsagen til klimaændringer. En af de bedste metoder er a -
 ASU forskning pryder forsiden af ACS tidsskriftEn ny undersøgelse fra biodesignforsker Gary Moore vises på forsiden af tidsskriftet i oktober ACS katalyse . Kredit:Jason Drees At publicere en videnskabelig artikel med stor gennemslagskraft
ASU forskning pryder forsiden af ACS tidsskriftEn ny undersøgelse fra biodesignforsker Gary Moore vises på forsiden af tidsskriftet i oktober ACS katalyse . Kredit:Jason Drees At publicere en videnskabelig artikel med stor gennemslagskraft -
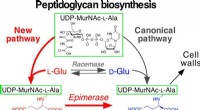 Ny biosyntetisk vej unik for patogene mikroorganismerDen nyligt opdagede vej involverer to gener, som letter bindingen af L-Glu til UDP-MurNAc-L-Ala og derefter epimeriserer (isomeriserer) L-Glu til D-Glu. Kredit:Dairi T. et al., Journal of the Americ
Ny biosyntetisk vej unik for patogene mikroorganismerDen nyligt opdagede vej involverer to gener, som letter bindingen af L-Glu til UDP-MurNAc-L-Ala og derefter epimeriserer (isomeriserer) L-Glu til D-Glu. Kredit:Dairi T. et al., Journal of the Americ
- Underjordisk anomali fundet nær det ikoniske Giza-pyramidekompleks
- Forskere beskriver, hvordan filosoffer kan bygge bro mellem videnskab og politik
- Hvordan udvindes feltspat?
- Fracking spildevand ophobning fundet i ferskvand muslingeskaller
- Når kystfarer truer din tur til Outer Banks
- Hvordan er vejret på Planet Mars?


