Lewis Dot -struktur til siliciumtetrahydrid?
1. Bestem det samlede antal valenselektroner:
* Silicium (SI) har 4 valenselektroner.
* Hydrogen (H) har 1 valenselektron hver.
* I alt:4 + (1 x 4) =8 valenselektroner
2. Bestem det centrale atom:
* Silicium (SI) er mindre elektronegativ end brint, hvilket gør det til det centrale atom.
3. Tilslut atomerne med enkeltbindinger:
* Placer siliciumatomet i midten, og tilslut det til hvert hydrogenatom med en enkelt binding. Hver binding repræsenterer to elektroner.
4. Distribuer de resterende elektroner:
* Du har brugt 8 elektroner (4 bindinger x 2 elektroner/binding) til at danne bindingerne. Du har 0 elektroner tilbage.
5. Kontroller oktetreglen:
* Silicium har nu 8 elektroner (4 bindinger x 2 elektroner/binding) omkring det, der opfylder octetreglen.
* Hvert hydrogenatom har 2 elektroner, der opfylder duetreglen.
Lewis Dot Structure:
`` `
H
|
H - si - h
|
H
`` `
Nøglepunkter:
* Lewis -prikstrukturen viser bindings- og ensomme par elektroner i et molekyle.
* Silicium -tetrahydrid er også kendt som silan.
* Det er en farveløs, brandfarlig gas, der bruges til produktion af siliciumskiver til mikrochips.
 Varme artikler
Varme artikler
-
 Molekylært stillads til modificering af fluorescerende forbindelser, der anvendes til biologisk bil…Et bibliotek af farvestofmolekyler syntetiseret med en modulær kemisk tilgang kan føre til forbedret billeddannelse af levende celler. Kredit:A*STAR Institute of Chemical and Engineering Sciences
Molekylært stillads til modificering af fluorescerende forbindelser, der anvendes til biologisk bil…Et bibliotek af farvestofmolekyler syntetiseret med en modulær kemisk tilgang kan føre til forbedret billeddannelse af levende celler. Kredit:A*STAR Institute of Chemical and Engineering Sciences -
 Vapor fix løfter perovskite krystal ydeevneDen nye bromdampbehandling forbedrer MAPbBr3 -krystallers transportegenskaber. I denne behandling, forskerne suspenderede krystallerne ovenfor i en forseglet beholder med flydende brom holdt ved stuet
Vapor fix løfter perovskite krystal ydeevneDen nye bromdampbehandling forbedrer MAPbBr3 -krystallers transportegenskaber. I denne behandling, forskerne suspenderede krystallerne ovenfor i en forseglet beholder med flydende brom holdt ved stuet -
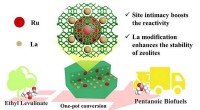 Zeolit-skræddersyet aktiv stednærhed til effektiv produktion af pentanoiske biobrændstofferZeolit-skræddersyet nærhed til aktivt sted øger den katalytiske aktivitet og selektivitet til direkte hydrodeoxygenering af rent ethyllevulinat til pentanoiske biobrændstoffer. Kredit:HE Jiang Ikk
Zeolit-skræddersyet aktiv stednærhed til effektiv produktion af pentanoiske biobrændstofferZeolit-skræddersyet nærhed til aktivt sted øger den katalytiske aktivitet og selektivitet til direkte hydrodeoxygenering af rent ethyllevulinat til pentanoiske biobrændstoffer. Kredit:HE Jiang Ikk -
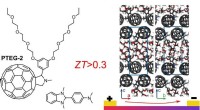 Gør varme til strøm med effektivt organisk termoelektrisk materialeDen kemiske struktur af fullerenderivatet, der anvendes i vores arbejde, forbedrer rækkefølgen af molekylerne som vist (til højre) i snapshots af den molekylære pakning. Ved at bruge et passende dop
Gør varme til strøm med effektivt organisk termoelektrisk materialeDen kemiske struktur af fullerenderivatet, der anvendes i vores arbejde, forbedrer rækkefølgen af molekylerne som vist (til højre) i snapshots af den molekylære pakning. Ved at bruge et passende dop
- Hvor mange forbindelser er der i 3H2O?
- 6 trin mod hjemløshed for at forbedre bistanden til unge
- Hvad er et andet navn på ikke -kontaktkraft?
- Når et objekt reflekterer lys, får det eller mister det energi?
- Global opvarmning vil udsætte flere millioner for oversvømmelser
- Fermi-missionen afslører sine gammastråleudbrud med højeste energi


