Når zinkmetal anbringes i en opløsning af kobbersulfatrosa, blev der dannet, men når stykke sølv ikke har nogen ændring observeret hvorfor?
Forståelse af reaktivitetsserien
Metaller har forskellige tendenser til at miste elektroner og danne positive ioner. Denne tendens er repræsenteret af reaktivitetsserien, der viser metaller i rækkefølge af faldende reaktivitet.
* stærkt reaktive metaller: Disse metaller mister let elektroner og danner positive ioner. De kan fortrænge mindre reaktive metaller fra deres løsninger.
* mindre reaktive metaller: Disse metaller holder fast i deres elektroner tættere og er mindre tilbøjelige til at danne ioner.
reaktionerne
* zink og kobbersulfat: Zink er mere reaktiv end kobber. Når zinkmetal anbringes i en kobbersulfatopløsning, opstår følgende reaktion:
`` `
Zn (s) + cuso₄ (aq) → Znso₄ (aq) + cu (s)
`` `
* Zink fortrænger kobber fra opløsningen og danner zinksulfat (Znso₄) og kobbermetal.
* Det kobbermetal, der er deponeret på zink, har en karakteristisk pink-brun farve.
* sølv- og kobbersulfat: Sølv er mindre reaktivt end kobber. Derfor opstår der ingen reaktion, når sølv anbringes i en kobbersulfatopløsning.
* Sølv kan ikke fortrænge kobber fra sin opløsning, fordi det er mindre sandsynligt, at det mister elektroner.
Kortfattet
Forskellen i reaktivitet mellem zink og sølv bestemmer, om der vil opstå en reaktion. Zink, der er mere reaktiv, fortrænger kobber fra dens opløsning, hvilket resulterer i en synlig farveændring. Sølv, der er mindre reaktiv, reagerer ikke med kobbersulfat.
Sidste artikelHvad sker der, når du kombinerer fluor og brint?
Næste artikelEr Beryllium et metal eller ikke -metal?
 Varme artikler
Varme artikler
-
 Måling af slid og ælde af metallerRørprøve til kraftværk sprængt ved intern trykkrybningstest. Kredit:National Institute for Materials Science (NIMS) I de sidste 50 år, forskere ved National Institute for Materials Science (NIMS)
Måling af slid og ælde af metallerRørprøve til kraftværk sprængt ved intern trykkrybningstest. Kredit:National Institute for Materials Science (NIMS) I de sidste 50 år, forskere ved National Institute for Materials Science (NIMS) -
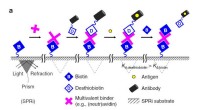 Bare at klikke et molekyle til et biomolekyle for en anden funktionEt desthiobiotin molekyle, inklusive antistof og et antigen, gør plads til biotin. Kredit:University of Twente Forskere har rapporteret et materiale, der styrer cellers adfærd på en dynamisk måde,
Bare at klikke et molekyle til et biomolekyle for en anden funktionEt desthiobiotin molekyle, inklusive antistof og et antigen, gør plads til biotin. Kredit:University of Twente Forskere har rapporteret et materiale, der styrer cellers adfærd på en dynamisk måde, -
 Brug af industriaffald som isolering til bygningerDe fire unge iværksættere bag FenX kender hinanden fra deres tid på Institut for Materialer på ETH Zürich. Kredit:ETH Zürich / Andres Eberhardt ETH-spinoff FenX omdanner industriaffald til et porø
Brug af industriaffald som isolering til bygningerDe fire unge iværksættere bag FenX kender hinanden fra deres tid på Institut for Materialer på ETH Zürich. Kredit:ETH Zürich / Andres Eberhardt ETH-spinoff FenX omdanner industriaffald til et porø -
 Nye lim klæber nemt, holder godt, og er en gas at trække fra hinandenNicholas Blelloch, Guarini 21, viser en midlertidig lim frem, der er stærk nok til at holde en ph.d.-kandidat, men kan frigives uden magt. Til dette foto, limen blev påført mellem karabinhagerne på to
Nye lim klæber nemt, holder godt, og er en gas at trække fra hinandenNicholas Blelloch, Guarini 21, viser en midlertidig lim frem, der er stærk nok til at holde en ph.d.-kandidat, men kan frigives uden magt. Til dette foto, limen blev påført mellem karabinhagerne på to
- Hvilket lag i jordens mantel glider pladerne over?
- Inverse fingeraftryk på papir:Visualisering af latente fingermærker ved hjælp af nanoteknologi
- Er salt en blanding eller et sammensat element?
- Sådan gør du subtraktion ved hjælp af optællingsmetoden
- Hvad er en type reproduktion, når der produceres en ny organismer undertiden mere end en, der har a…
- Kan du tid rejse til fortiden?


