Hvad er orbitaldiagrammet for fluor?
1. Elektronisk konfiguration:
* Fluor har et atomnummer på 9, hvilket betyder, at det har 9 elektroner.
* Dens elektroniske konfiguration er 1S² 2s² 2p⁵
2. Orbital diagram:
* 1s orbital: Denne orbital har maksimalt 2 elektroner. Repræsentere det som en cirkel med to pile, der peger i modsatte retninger (op og ned) for at repræsentere spin på elektronerne:
* ↑ ↓ (1s)
* 2s orbital: Denne orbital har også maksimalt 2 elektroner:
* ↑ ↓ (2s)
* 2p orbitaler: Der er tre 2p orbitaler (2px, 2py og 2pz), der hver er i stand til at holde 2 elektroner.
* Da fluor har 5 elektroner i sit 2P -underskal, udfylder vi dem som følger:
* ↑ ↑ ↑ (2px, 2py, 2pz)
* ↓ (2px)
Komplet orbitaldiagram:
`` `
↑ ↓ (1s)
↑ ↓ (2s)
↑ ↑ ↑ (2px, 2py, 2pz)
↓ (2px)
`` `
Nøglepunkter:
* Hunds regel: Elektroner udfylder individuelle orbitaler inden for et underskal, før de parrer sig sammen i den samme orbital.
* Pauli Ekskluderingsprincip: Ingen to elektroner i et atom kan have det samme sæt med fire kvantetal. Dette betyder, at hver orbital maksimalt kan holde to elektroner med modsatte spins.
 Varme artikler
Varme artikler
-
 Ikke alle naturens lagdelte strukturer er hårde som dyreskaller og gevirer, undersøgelse finderAnkerpiggene, der holder svampearten Euplectella aspergillum til havbunden, har en indviklet lagdelt indre struktur. Lignende lagdelte strukturer er kendt for at øge sejheden af materialer som knogl
Ikke alle naturens lagdelte strukturer er hårde som dyreskaller og gevirer, undersøgelse finderAnkerpiggene, der holder svampearten Euplectella aspergillum til havbunden, har en indviklet lagdelt indre struktur. Lignende lagdelte strukturer er kendt for at øge sejheden af materialer som knogl -
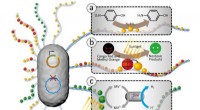 Konstruerede bakterielle biofilm, der immobiliserer nanopartikler, muliggør forskellige katalytiske…Forskellige katalytiske anvendelser af tunable funktionel E coli biofilm med forankrede nanoobjekter. (a) De biofilmforankrede Au NPer muliggør den genanvendelige katalytiske reduktion af den giftig
Konstruerede bakterielle biofilm, der immobiliserer nanopartikler, muliggør forskellige katalytiske…Forskellige katalytiske anvendelser af tunable funktionel E coli biofilm med forankrede nanoobjekter. (a) De biofilmforankrede Au NPer muliggør den genanvendelige katalytiske reduktion af den giftig -
 Maskinlæring muliggør et hidtil uset kig på polymerer, der er nyttige inden for biomedicinsk områ…Et team af forskere har udviklet en metode til at undersøge strukturerne af polymerer, der er følsomme over for ydre stimuli. Venstre til højre, Yaxin An, Karteek Bejagam, og Sanket Deshmukh. Kredit:V
Maskinlæring muliggør et hidtil uset kig på polymerer, der er nyttige inden for biomedicinsk områ…Et team af forskere har udviklet en metode til at undersøge strukturerne af polymerer, der er følsomme over for ydre stimuli. Venstre til højre, Yaxin An, Karteek Bejagam, og Sanket Deshmukh. Kredit:V -
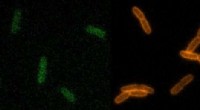 Forskning går fremad med søgning efter nye antibiotikaCellevæggene i levende bakterier lyser grønt, orange og rød med tre forskellige typer RfDAA -prober. Kredit:VanNieuwenhze Lab, Indiana University Indiana University forskere fremmer viden om, hvor
Forskning går fremad med søgning efter nye antibiotikaCellevæggene i levende bakterier lyser grønt, orange og rød med tre forskellige typer RfDAA -prober. Kredit:VanNieuwenhze Lab, Indiana University Indiana University forskere fremmer viden om, hvor
- Mikoyan-Guryevich MiG-15
- Ny undersøgelse afslører, at grafener nu går monolag og enkelt krystallinske
- Hvad er enhederne til kortslutningsstrøm?
- Hvordan cykler energi gennem biosfæren?
- Total syntese af flueggenin C via en accelereret intermolekylær Rauhut-Currier reaktion
- Navngiv de tre hovedgrupper af klipper og beskriv, hvordan hver former?


