Hvorfor er ionisk forbindelse normalt faste og sprøde ved stuetemperatur?
1. Stærke elektrostatiske kræfter:
Ioniske forbindelser holdes sammen af stærke elektrostatiske kræfter mellem modsat ladede ioner. Disse kræfter er meget stærke og skaber en stiv, tredimensionel gitterstruktur.
2. Bestilt struktur:
Ionerne i en ionisk forbindelse er arrangeret i en stærkt ordnet, krystallinsk struktur. Denne struktur minimerer den elektrostatiske frastødelse mellem ioner af samme ladning og maksimerer tiltrækningen mellem modsat ladede ioner.
3. Mangel på frie elektroner:
Ioniske forbindelser har ikke frie elektroner. Dette betyder, at de ikke let kan deformeres eller flyder under pres, da der ikke er nogen mobilafgiftsselskaber til at lette bevægelse.
4. Sprød natur:
Når en ekstern kraft påføres en ionisk krystal, forskydes ionerne fra deres ligevægtspositioner. Denne forskydning bryder de stærke elektrostatiske bindinger, hvilket fører til et brud langs specifikke svaghedsplaner i krystalgitteret. Den sprøde natur opstår, fordi de stærke ioniske bindinger modstår bøjning eller strækning, og forstyrrelsen af disse bindinger fører til en pludselig brud snarere end en gradvis deformation.
5. Høje smelte- og kogepunkter:
De stærke elektrostatiske kræfter mellem ioner kræver en masse energi til at overvinde, hvilket resulterer i høje smelte- og kogepunkter for de fleste ioniske forbindelser.
Kortfattet: De stærke elektrostatiske kræfter mellem ioner, den ordnede krystallinske struktur og manglen på frie elektroner bidrager til den faste, sprøde natur af ioniske forbindelser ved stuetemperatur.
Sidste artikelHvor mange atomer er der i C3?
Næste artikelHvad beskriver de 2 slags forbindelser hver?
 Varme artikler
Varme artikler
-
 Nyt glød-i-mørke materiale kan spore stoffers vej gennem menneskekroppenKredit:Unsplash/CC0 Public Domain Forskere fra Western University har udviklet et materiale, der i sidste ende kan forbedre måden, hvorpå lægemidler administreres til patienter, ved at tillade læge
Nyt glød-i-mørke materiale kan spore stoffers vej gennem menneskekroppenKredit:Unsplash/CC0 Public Domain Forskere fra Western University har udviklet et materiale, der i sidste ende kan forbedre måden, hvorpå lægemidler administreres til patienter, ved at tillade læge -
 Dekontaminering af industrielt plastikaffald for at lette planeternes byrdeKredit:Sofi_Design, Shutterstock Med Europas ambitiøse strategi for plastgenbrug og voksende offentlig bevidsthed, en plastikforureningsfri fremtid synes mere og mere mulig på trods af nuværende f
Dekontaminering af industrielt plastikaffald for at lette planeternes byrdeKredit:Sofi_Design, Shutterstock Med Europas ambitiøse strategi for plastgenbrug og voksende offentlig bevidsthed, en plastikforureningsfri fremtid synes mere og mere mulig på trods af nuværende f -
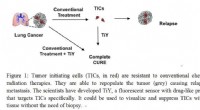 Alsidig sensor mod tumorinitierende cellerDe fleste kræftdødsfald skyldes tilbagevendende eller metastatiske tumorer. Konventionelle terapier er målrettet mod hurtigt delende tumorceller, men er ude af stand til at udrydde de stærkt kemoresis
Alsidig sensor mod tumorinitierende cellerDe fleste kræftdødsfald skyldes tilbagevendende eller metastatiske tumorer. Konventionelle terapier er målrettet mod hurtigt delende tumorceller, men er ude af stand til at udrydde de stærkt kemoresis -
 Undersøgelse foreslår vej til forbedring af genopladelige lithium-batterierNy forskning tyder på, at opnåelse af glattere overflader på en fast elektrolyt kan eliminere eller i høj grad reducere problemet med dendritdannelse. De fleste af nutidens lithium-ion-batterier,
Undersøgelse foreslår vej til forbedring af genopladelige lithium-batterierNy forskning tyder på, at opnåelse af glattere overflader på en fast elektrolyt kan eliminere eller i høj grad reducere problemet med dendritdannelse. De fleste af nutidens lithium-ion-batterier,
- Kommer uddøde vira tilbage takket være klimaændringer?
- Astronomi og landskab i byen Caral, den ældste by i Amerika
- Undersøgelse finder stærk skel mellem militærmænd, kvinder på kønsneutrale badeværelser, fors…
- Afrikas forskningsøkosystem har brug for en mentorkultur
- Hvad er uigennemsigtig gas?
- Hvad er iltindholdet i luft?


