Når kalium ferro cyanid og ferrisk ammonium kombinerer, bliver det preussisk blåt?
Her er den forenklede reaktion:
3 k₄ [Fe (CN) ₆] + 4 fecl₃ → Fe₄ [Fe (CN) ₆] ₃ + 12 kCl
Forklaring:
* kaliumferrocyanid (K₄ [Fe (CN) ₆]) indeholder ferrocyanidion [Fe (CN) ₆] ⁴⁻, som har jern i +2 oxidationstilstand.
* ferrisk ammonium (Fecl₃) indeholder ferriskion fe³⁺.
* Reaktionen involverer en redox -reaktion hvor jern i +2 tilstand (ferrocyanid) oxideres til +3 tilstand (prøyssisk blå), mens jern i +3 tilstand (ferrisk ammonium) reduceres til +2 tilstand (prøyssisk blå).
* Resultatet er dannelsen af preussisk blå, en kompleks forbindelse med en dyb blå farve sammen med kaliumchlorid (KCL) som et biprodukt.
Preussisk blå er blevet brugt i århundreder som et pigment i maling, blæk og farvestoffer. Det bruges også i nogle industrielle processer og til dets evne til at absorbere radioaktivt cæsium.
Sidste artikelHvad er massen af svovldioxid?
Næste artikelHvor mange samlede valenselektroner er der i den sammensatte PCL3?
 Varme artikler
Varme artikler
-
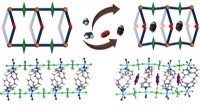 Absorberet pasform til acetylenKredit:Wiley Vi siger ofte, at et substrat passer ind i sit enzym som en nøgle i en lås, men denne metafor er ufuldkommen. Substratbinding kan også ændre låsen (enzymets struktur) for at fremkalde
Absorberet pasform til acetylenKredit:Wiley Vi siger ofte, at et substrat passer ind i sit enzym som en nøgle i en lås, men denne metafor er ufuldkommen. Substratbinding kan også ændre låsen (enzymets struktur) for at fremkalde -
 Svampeenzymer kan holde hemmeligheden bag fremstillingen af vedvarende energi fra træEn overordnet tredimensionel struktur af en af denne klasse af enzymer. Kredit:Professor Gideon Davies, University of York Et internationalt team af forskere, inklusive videnskabsmænd fra Univer
Svampeenzymer kan holde hemmeligheden bag fremstillingen af vedvarende energi fra træEn overordnet tredimensionel struktur af en af denne klasse af enzymer. Kredit:Professor Gideon Davies, University of York Et internationalt team af forskere, inklusive videnskabsmænd fra Univer -
 3D-print af stivelse til personlig udvikling af medicin3D-print gør det muligt at fremstille personaliserede lægemidler skræddersyet til den enkelte patient. Kredit:UPV/EHU Traditionelle metoder producerer lægemidler med specifikke parametre, men i man
3D-print af stivelse til personlig udvikling af medicin3D-print gør det muligt at fremstille personaliserede lægemidler skræddersyet til den enkelte patient. Kredit:UPV/EHU Traditionelle metoder producerer lægemidler med specifikke parametre, men i man -
 Farveændringstest for at hjælpe kræftforskningen videreKredit:shapecharge iStock En simpel farveændringstest til at hjælpe videnskabsmænd med at undersøge potentielle kræftlægemidler er blevet udviklet af University of Bath-forskere, gør det muligt fo
Farveændringstest for at hjælpe kræftforskningen videreKredit:shapecharge iStock En simpel farveændringstest til at hjælpe videnskabsmænd med at undersøge potentielle kræftlægemidler er blevet udviklet af University of Bath-forskere, gør det muligt fo
- Er solen en form for lys?
- Ja, kvinder er flere end mænd på universitetet. Men de tjener stadig mindre, efter de er gået
- Hvad er den vigtigste bestanddel af solen?
- Hvorfor er øjet af en orkansky fri?
- Hvad er kontroloverflade med hensyn til termodynamik?
- Hvilket generelt mønster findes på en graf over radioaktivt forfald?


