Hvordan adskiller bromen sig fra de andre halogener og ikke -metaller?
1. Fysisk tilstand:
* brom er en væske ved stuetemperatur. Dette gør det unikt blandt halogenerne, da de andre er gasser (fluor, klor) eller faste stoffer (jod, astatin). Denne flydende tilstand skyldes dens relativt stærke intermolekylære kræfter (van der Waals -kræfter) mellem dens molekyler.
2. Reaktivitet:
* Brom er mindre reaktiv end fluor og klor, men mere reaktiv end jod. Dette er en generel tendens i halogenerne:reaktivitet falder, når du går ned i gruppen. Dette skyldes den faldende elektronegativitet af halogenerne ned i gruppen, hvilket gør dem mindre tilbøjelige til at få elektroner.
* brom er et godt oxidationsmiddel. Den accepterer let elektroner til dannelse af bromidioner (BR-), der deltager i forskellige kemiske reaktioner.
3. Udseende og lugt:
* brom er en rødbrun væske med en skarp, irriterende lugt. Det er meget flygtigt, hvilket betyder, at det let fordamper til en rødbrun gas. Denne damp er giftig og kan forårsage alvorlig åndedrætsirritation.
4. Biologiske effekter:
* Brom er vigtig i spormængder for nogle biologiske processer. Det findes i visse enzymer og spiller en rolle i reguleringen af nervefunktionen.
* Overskydende brom kan dog være giftig. Det kan forårsage irritation i huden, øjne og åndedrætssystem.
5. Ansøgninger:
* brom har en række industrielle applikationer. Det bruges til produktion af flammehæmmere, pesticider, farmaceutiske stoffer og desinfektionsmidler.
* Det bruges også i produktionen af bromidsalte, der har forskellige applikationer. Disse inkluderer fotografering, farmaceutiske stoffer og borevæsker.
Her er en sammenligning med andre halogener og ikke -metaller:
* halogener: Fluor og klor er gasser ved stuetemperatur, jod er et fast stof. Brom skiller sig ud som den eneste flydende halogen. De danner alle diatomiske molekyler (F2, CL2, BR2, I2) og er meget reaktive, men fluor og klor er de mest reaktive.
* ikke -metaller: Mange ikke -metaller er gasser ved stuetemperatur (f.eks. Nitrogen, ilt, kuldioxid). Nogle er faste stoffer (f.eks. Carbon, svovl, fosfor). Brom adskiller sig som den eneste flydende ikke -metal.
Afslutningsvis gør Bromins unikke fysiske egenskaber, reaktivitet og applikationer det til et interessant og vigtigt element. Mens de deler almindelige egenskaber med andre halogener og ikke -metaller, adskiller dens flydende tilstand ved stuetemperatur og dens position i reaktivitetsserien den som et tydeligt og værdifuldt element.
Sidste artikelHvilke forbindelser er disse CH3CH2CH2CH2CH2CH3?
Næste artikelHvor kommer oxider fra?
 Varme artikler
Varme artikler
-
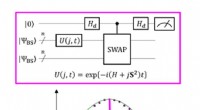 Gentænke spinkemi fra et kvanteperspektivEt kvantekredsløb, der muliggør den maksimale sandsynlighed for P(0) ved måling af parameteren J. Kredit:K. Sugisaki, K. Sato og T. Takui Forskere ved Osaka City University bruger kvantesuperposit
Gentænke spinkemi fra et kvanteperspektivEt kvantekredsløb, der muliggør den maksimale sandsynlighed for P(0) ved måling af parameteren J. Kredit:K. Sugisaki, K. Sato og T. Takui Forskere ved Osaka City University bruger kvantesuperposit -
 Ny forståelse af kondensering kan føre til en bedre kraftværkskondensator, afisningsmaterialerKandidatstuderende Hyeongyun Cha, postdoc-forsker Soumyadip Sett, professor Nenad Miljkovic og bachelorstuderende Stephen Bosch udfordrer en ældgammel teori om de processer, der styrer rensningen af
Ny forståelse af kondensering kan føre til en bedre kraftværkskondensator, afisningsmaterialerKandidatstuderende Hyeongyun Cha, postdoc-forsker Soumyadip Sett, professor Nenad Miljkovic og bachelorstuderende Stephen Bosch udfordrer en ældgammel teori om de processer, der styrer rensningen af -
 Forskere udvikler en kraftfuld familie af 2D-materialerKredit:CC0 Public Domain Et hold fra Tulane University School of Science and Engineering har udviklet en ny familie af todimensionelle materialer, som forskere siger har lovende anvendelser, herund
Forskere udvikler en kraftfuld familie af 2D-materialerKredit:CC0 Public Domain Et hold fra Tulane University School of Science and Engineering har udviklet en ny familie af todimensionelle materialer, som forskere siger har lovende anvendelser, herund -
 Ny elektrokatalysator til brintproduktion med forbedret faradaisk effektivitetFigur 1. Sammenligning af overpotentialerne ved 10 mA cm − 2 med nyligt rapporterede HER -katalysatorer under både sure og alkaliske forhold. Kredit:Professor Jong-Beom Baek, UNIST Forskere over h
Ny elektrokatalysator til brintproduktion med forbedret faradaisk effektivitetFigur 1. Sammenligning af overpotentialerne ved 10 mA cm − 2 med nyligt rapporterede HER -katalysatorer under både sure og alkaliske forhold. Kredit:Professor Jong-Beom Baek, UNIST Forskere over h
- Hvordan får dyreceller der energi?
- Hvilket kendetegn ved en civilisation giver normalt et sundt grundlag for fremskridt inden for kunst…
- Bæredygtig brændstof til verden:Syntetisering af ammoniak ved brug af mindre energi
- Høje rater af chikane-adfærd observeret i obstetrik og gynækologi
- Retsmedicinske metoder til at få data fra beskadigede mobiltelefoner
- Er du villig til at betale for at se videoklip online?


