Hvad smelter is hurtigere calciumchlorid eller natriumchlorid?
Her er hvorfor:
* Nedre frysepunktdepression: Calciumchlorid har en lavere frysepunktdepression end natriumchlorid. Dette betyder, at det i større grad kan sænke vandets frysepunkt, hvilket gør det mere effektivt til at smelte is ved lavere temperaturer.
* flere ioner frigivet: Calciumchlorid dissocieres i tre ioner i opløsning (en calciumion og to chloridioner), mens natriumchlorid dissocierer i kun to ioner (en natriumion og en chloridion). Det større antal ioner i opløsning fra calciumchlorid fører til en større frysepunktdepression.
* Hygroskopisk natur: Calciumchlorid er meget hygroskopisk, hvilket betyder, at det let absorberer fugt fra luften. Dette bidrager yderligere til dens effektivitet i smeltende is ved at tilvejebringe flere vandmolekyler til at opløse og sænke frysepunktet.
I praktisk termer bruges calciumchlorid ofte i vejafisningsanvendelser, fordi det kan være effektivt ved lavere temperaturer end natriumchlorid.
Det er dog vigtigt at bemærke, at:
* Calciumchlorid kan være mere ætsende for beton og andre materialer.
* Både calciumchlorid og natriumchlorid kan skade vegetation og jord.
* Brug af overdreven mængder af enten salt kan have negativ indflydelse på miljøet.
 Varme artikler
Varme artikler
-
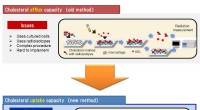 En ny praktisk test for funktionen af HDL, bæreren af det gode kolesterolKolesteroludstrømningskapacitet og optagelseskapacitet er vist. Kredit:Kobe University High-density lipoprotein kolesterol (HDL-C) er kendt som godt kolesterol, fordi HDL-partikler fjerner oversky
En ny praktisk test for funktionen af HDL, bæreren af det gode kolesterolKolesteroludstrømningskapacitet og optagelseskapacitet er vist. Kredit:Kobe University High-density lipoprotein kolesterol (HDL-C) er kendt som godt kolesterol, fordi HDL-partikler fjerner oversky -
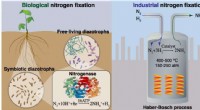 Udforskning af grønnere tilgange til nitrogenfikseringNitrogenfiksering forekommer naturligt i bakterier, der indeholder nitrogenase-enzymet, og kan udføres kunstigt gennem en højtemperatur- og højtryksindustriel proces, der er afhængig af jernbaserede k
Udforskning af grønnere tilgange til nitrogenfikseringNitrogenfiksering forekommer naturligt i bakterier, der indeholder nitrogenase-enzymet, og kan udføres kunstigt gennem en højtemperatur- og højtryksindustriel proces, der er afhængig af jernbaserede k -
 Design af naturbaserede syntetiske materialerKredit:CC0 Public Domain Siden menneskehedens begyndelse udvikler og forbedrer vi materialer med bedre og mere optimerede materialeegenskaber. Ved at forstå, hvordan naturlige materialer fremstill
Design af naturbaserede syntetiske materialerKredit:CC0 Public Domain Siden menneskehedens begyndelse udvikler og forbedrer vi materialer med bedre og mere optimerede materialeegenskaber. Ved at forstå, hvordan naturlige materialer fremstill -
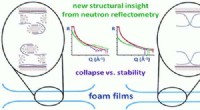 Skål! Forskere tager et stort skridt i retning af at lave det perfekte hoved af ølKredit: Kemisk kommunikation (2019). DOI:10.1039/C9CC08470C Drikkere vil snart juble hele vejen til baren takket være et team af forskere, der har taget et stort skridt fremad med at løse gåden o
Skål! Forskere tager et stort skridt i retning af at lave det perfekte hoved af ølKredit: Kemisk kommunikation (2019). DOI:10.1039/C9CC08470C Drikkere vil snart juble hele vejen til baren takket være et team af forskere, der har taget et stort skridt fremad med at løse gåden o


