Beregn pH på et 0,01M opløsning natriumacetat?
1. Forstå kemi
* Natriumacetat (nach₃coo) er salt af en svag syre (eddikesyre, ch₃cooh) og en stærk base (natriumhydroxid, NaOH).
* Når natriumacetat opløses i vand, adskiller det sig fuldstændigt i natriumioner (Na⁺) og acetationer (ch₃coo⁻).
* Acetationerne reagerer med vand i en ligevægtsreaktion for at producere hydroxidioner (OH⁻) og eddikesyre (CH₃cooh), hvilket gør opløsningen lidt grundlæggende.
2. Opret ligevægten
Den relevante ligevægtsreaktion er:
Ch₃coo⁻ (aq) + h₂o (l) ⇌ ch₃cooh (aq) + OH⁻ (aq)
3. Brug KB -udtrykket
Vi er nødt til at bruge basisdissocieringskonstanten (KB) til acetation til at beregne hydroxidionkoncentrationen:
KB =[CH₃COOH] [OH⁻] / [CH₃COO⁻]
* Vi kan finde KB -værdien for acetat i en tabel (slå Ka op for eddikesyre og bruge forholdet Kb * ka =kW, hvor kw =1,0 x 10⁻¹⁴). KB for acetat er ca. 5,6 x 10⁻¹⁰.
4. Opret et isbord
Vi bruger en is (indledende, ændring, ligevægt) -tabel til at bestemme ligevægtskoncentrationerne:
| | Ch₃coo⁻ | Ch₃cooh | Oh⁻ |
| ----------- | ---------- | ---------- | --------- |
| Indledende | 0,01 m | 0 | 0 |
| Ændring | -x | +x | +x |
| Ligevægt | 0,01 - x | X | X |
5. Løs for x ([oh⁻])
Udskift ligevægtskoncentrationerne i KB -ekspressionen:
5,6 x 10⁻¹⁰ =(x) (x) / (0,01 - x)
Da KB er meget lille, kan vi antage, at X er meget mindre end 0,01, så vi kan forenkle ligningen:
5,6 x 10⁻¹⁰ ≈ x² / 0,01
Løs for x:
x² ≈ 5,6 x 10⁻¹²
x ≈ 2,37 x 10⁻⁶ m (dette er [OH⁻])
6. Beregn POH
POH =-log [oh⁻] =-log (2,37 x 10⁻⁶) ≈ 5,63
7. Beregn pH
Ph + POH =14
pH =14 - POH =14 - 5,63 ≈ 8,37
Derfor er pH af en 0,01 m opløsning af natriumacetat ca. 8,37.
Sidste artikelHvad er CO2 -opladning?
Næste artikelHvorfor aluminiumchlorid sublimt ved 180 grader Celsius?
 Varme artikler
Varme artikler
-
 Et enkelt fingeraftryk på gerningsstedet opdager stofmisbrug i klasse AKredit:CC0 Public Domain National Center of Excellence in Mass Spectrometry Imaging hos NPL, i samarbejde med University of Surrey og Ionoptika Ltd afslører de seneste fund, der viser, hvordan et
Et enkelt fingeraftryk på gerningsstedet opdager stofmisbrug i klasse AKredit:CC0 Public Domain National Center of Excellence in Mass Spectrometry Imaging hos NPL, i samarbejde med University of Surrey og Ionoptika Ltd afslører de seneste fund, der viser, hvordan et -
 Fremstilling af polymerstrukturer hurtigere - to processer i en maskineMålet er at bruge kombimaskinen til at producere forgrenede mikrorør samt komplette mikrofluidiske systemer. Kredit:Fraunhofer ILT, Aachen, Tyskland Enten hurtigt eller præcist - begge dele kan ik
Fremstilling af polymerstrukturer hurtigere - to processer i en maskineMålet er at bruge kombimaskinen til at producere forgrenede mikrorør samt komplette mikrofluidiske systemer. Kredit:Fraunhofer ILT, Aachen, Tyskland Enten hurtigt eller præcist - begge dele kan ik -
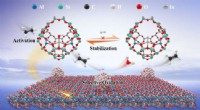 Forskere skræddersyer hovedgruppekatalysator med atomisk spredte In-steder til højeffektiv oxidati…Skematisk over det lokale koordinationsmiljø for isoleret In-sted og foreslået selektiv oxidativ dehydrogeneringsproces på hovedgruppe In-katalysator. Kredit:WANG Chaojie Overgangsmetaloxider er ka
Forskere skræddersyer hovedgruppekatalysator med atomisk spredte In-steder til højeffektiv oxidati…Skematisk over det lokale koordinationsmiljø for isoleret In-sted og foreslået selektiv oxidativ dehydrogeneringsproces på hovedgruppe In-katalysator. Kredit:WANG Chaojie Overgangsmetaloxider er ka -
 Spider silke nøgle til nyt knoglefiksende kompositEn 3D-gengivelse af et nyt knoglefiksende komposit udviklet af et forskerhold ledet af UConn materialeforsker Mei Wei. Kredit:Bryant Heimbach/UConn UConn-forskere har skabt et bionedbrydeligt komp
Spider silke nøgle til nyt knoglefiksende kompositEn 3D-gengivelse af et nyt knoglefiksende komposit udviklet af et forskerhold ledet af UConn materialeforsker Mei Wei. Kredit:Bryant Heimbach/UConn UConn-forskere har skabt et bionedbrydeligt komp
- Hvad er den bedste måde at observere Jupiter gennem et teleskop?
- Hvad er en kg grundlæggende metrisk enhed?
- Hvordan sammenligner Venus -atmosfære med jorden?
- Hvad er teorier om oprindelsesjorden?
- Hvor brint kommer fra?
- Hvordan nye beviser for kønsvendinger hjælper med at vise, hvordan kromosomer opretholdes over evo…


