Hvorfor aluminiumchlorid sublimt ved 180 grader Celsius?
1. Svage intermolekylære kræfter:
* Alcl₃ findes som en dimer, al₂cl₆, i fast tilstand.
* Den dimere struktur holdes sammen af relativt svage van der Waals-kræfter og dipol-dipol-interaktioner.
* Disse svage kræfter overvindes let af termisk energi, hvilket gør det muligt for molekylerne at skifte direkte fra det faste stof til gasfasen.
2. Kovalent binding:
* Al-CL-bindingerne inden for al₂cl₆-dimeren er stærke kovalente bindinger.
* Denne stærke intramolekylære binding bidrager til stabiliteten i den gasformige fase, hvilket gør sublimering gunstig.
3. Polaritet:
* ALCL₃ er et polært molekyle på grund af elektronegativitetsforskellen mellem aluminium og klor.
* Molekylets polære karakter bidrager yderligere til dens tendens til at eksistere i gasfasen.
4. Lav gitterenergi:
* Alcl₃s gitterenergi er relativt lav på grund af de svage intermolekylære kræfter.
* Denne lave gitterenergi betyder, at der kræves mindre energi for at bryde den faste struktur og overgangen til den gasformige tilstand.
5. Sublimering er en endotermisk proces:
* Sublimering er en endotermisk proces, hvilket betyder, at den kræver, at varmeenergi forekommer.
* Ved 180 ° C er den leverede termiske energi tilstrækkelig til at overvinde de intermolekylære kræfter og lade alcl₃ -molekylerne flygte ind i den gasformige fase.
Sammenfattende tillader kombinationen af svage intermolekylære kræfter, stærk kovalent binding, polaritet, lav gitterenergi og den endotermiske karakter af sublimering aluminiumchlorid til sublim ved 180 ° C.
 Varme artikler
Varme artikler
-
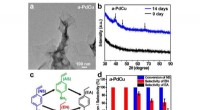 Heterofase nanostrukturer, der bidrager til effektiv katalyse(a) TEM-billede af a-PdCu nanoark. (b) XRD-mønstre af den som syntetiserede (0 dage) a-PdCu og a-PdCu efter ældning i 14 dage. (c) Hydrogeneringsreaktion af 4-nitrostyren (stuetemperatur, H2 ballon).
Heterofase nanostrukturer, der bidrager til effektiv katalyse(a) TEM-billede af a-PdCu nanoark. (b) XRD-mønstre af den som syntetiserede (0 dage) a-PdCu og a-PdCu efter ældning i 14 dage. (c) Hydrogeneringsreaktion af 4-nitrostyren (stuetemperatur, H2 ballon). -
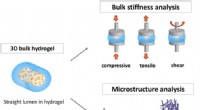 Semi-fleksibel modelbaseret analyse af celleadhæsion til hydrogelerSkematisk repræsentation af metoder til karakterisering af hydrogels fysiske egenskaber:hydrogels bulkstivhed og kædefleksibilitet i viskoelastiske netværk gennem den semi-fleksible model. Kredit: Vid
Semi-fleksibel modelbaseret analyse af celleadhæsion til hydrogelerSkematisk repræsentation af metoder til karakterisering af hydrogels fysiske egenskaber:hydrogels bulkstivhed og kædefleksibilitet i viskoelastiske netværk gennem den semi-fleksible model. Kredit: Vid -
 Forskere udgiver køreplan for at udnytte datavidenskab og kunstig intelligens til elektronmikroskop…Kredit:CC0 Public Domain Siden de blev taget i brug i 1938, elektronmikroskoper har spillet en afgørende rolle i en lang række videnskabelige fremskridt, herunder opdagelsen af nye proteiner og
Forskere udgiver køreplan for at udnytte datavidenskab og kunstig intelligens til elektronmikroskop…Kredit:CC0 Public Domain Siden de blev taget i brug i 1938, elektronmikroskoper har spillet en afgørende rolle i en lang række videnskabelige fremskridt, herunder opdagelsen af nye proteiner og -
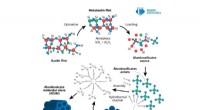 Kemiker skaber katalysator til at producere anti-mygstofferKredit:RUDN University En kemiker fra RUDN University har udviklet en katalysator til produktion af eugenolacetat, et stof, der ødelægger myggens larver, der overfører farlige sygdomme. Artiklen b
Kemiker skaber katalysator til at producere anti-mygstofferKredit:RUDN University En kemiker fra RUDN University har udviklet en katalysator til produktion af eugenolacetat, et stof, der ødelægger myggens larver, der overfører farlige sygdomme. Artiklen b


