Hvad vil danne en ionisk binding med nitrogen?
Her er grunden til, at nitrogen foretrækker kovalent binding:
* Elektronegativitet: Nitrogens elektronegativitet er relativt høj (3,04 i Pauling -skalaen). Dette gør det vanskeligt for nitrogen at miste elektroner at danne en positiv ion (kation).
* ioniseringsenergi: Kvælstof har en høj ioniseringsenergi, hvilket betyder, at det kræver en masse energi for at fjerne en elektron. Dette gør det ugunstigt for nitrogen at danne en kation.
Der er dog et par undtagelser, hvor nitrogen * kan * danne en ionisk binding:
* med stærkt elektropositive metaller: Nitrogen kan reagere med nogle stærkt elektropositive metaller som lithium (Li) og calcium (Ca) for at danne ioniske forbindelser som LI3N (lithiumnitrid) og Ca3N2 (calciumnitrid). I disse tilfælde mister metallet let elektroner til dannelse af en kation, mens nitrogen får elektroner til at danne en nitridanion (n³⁻).
Kortfattet:
* Nitrogen danner generelt kovalente bindinger På grund af dets høje elektronegativitet og ioniseringsenergi.
* Det kan danne ioniske obligationer med nogle meget elektropositive metaller.
 Varme artikler
Varme artikler
-
 Kemikere opnår hidtil uset molekylært tredobbelthop med multi-ringede metalkomplekserTexas A&M Fremstående professor i kemi John A. Gladysz, forklarer den reaktionære mekanik involveret i et molekylært gyroskop. Kredit:Texas A&M University I årtier, Texas A&M University -kemiker D
Kemikere opnår hidtil uset molekylært tredobbelthop med multi-ringede metalkomplekserTexas A&M Fremstående professor i kemi John A. Gladysz, forklarer den reaktionære mekanik involveret i et molekylært gyroskop. Kredit:Texas A&M University I årtier, Texas A&M University -kemiker D -
 Nyt koncept til at identificere kemiske kombinationer med potentielle sundhedseffekterKredit:CC0 Public Domain Omkring 350, 000 kemikalier er registreret på verdensplan. Nogle af disse kan bidrage til menneskers eksponering for stoffer og blandinger via produkter, applikationer ell
Nyt koncept til at identificere kemiske kombinationer med potentielle sundhedseffekterKredit:CC0 Public Domain Omkring 350, 000 kemikalier er registreret på verdensplan. Nogle af disse kan bidrage til menneskers eksponering for stoffer og blandinger via produkter, applikationer ell -
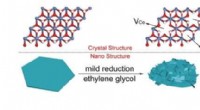 Rige defekter, der øger iltudviklingsreaktionenIllustration af den solvotermiske reaktion af uberørte CoFe LDHer ved at bruge ethylenglycol. Kredit:©Science China Press Iltudviklingsreaktionen (OER) med træg reaktionskinetik og stort overpoten
Rige defekter, der øger iltudviklingsreaktionenIllustration af den solvotermiske reaktion af uberørte CoFe LDHer ved at bruge ethylenglycol. Kredit:©Science China Press Iltudviklingsreaktionen (OER) med træg reaktionskinetik og stort overpoten -
 Grøn brint:Forskning for at øge effektivitetenHovedforfatteren til undersøgelsen, Aleksandr Bashkatov fra Institute of Fluid Dynamics. Kredit:HZDR / Stephan Floss Laboratorieeksperimenter og en parabolflyvningskampagne har gjort det muligt fo
Grøn brint:Forskning for at øge effektivitetenHovedforfatteren til undersøgelsen, Aleksandr Bashkatov fra Institute of Fluid Dynamics. Kredit:HZDR / Stephan Floss Laboratorieeksperimenter og en parabolflyvningskampagne har gjort det muligt fo
- Hvilke bølger er det, der rejser udad fra det episenter, der kaldes?
- Havsygt:Plastaffald i det nordlige Atlanterhav skyder i vejret
- Militært affald har uventede konsekvenser for civile, miljøet
- Hvor mange ounces er 700 ml?
- Løsning på det hyperfine puslespil inden for rækkevidde
- Forskere undersøger, hvordan forskellige flydende organeller i celler skabes


