Hvad ville ladningen af stabil ion svovl være?
Her er hvorfor:
* Svovls elektronkonfiguration: Svovl har 16 elektroner med konfigurationen:2, 8, 6. Dette betyder, at det har 6 elektroner i sin yderste skal (valenselektroner).
* octet regel: Atomer har en tendens til at vinde eller miste elektroner for at opnå en fuld ydre skal af 8 elektroner (Octet -regel).
* Svovls præference: For at opnå en octet foretrækker svovl * at vinde * 2 elektroner, hvilket giver den et gebyr på -2. Dette danner sulfidion (s²⁻).
Svovl kan også danne andre ioner, som S⁴⁺, men -2 er den mest stabile og almindelige form.
 Varme artikler
Varme artikler
-
 Undersøgelse identificerer kemiske blandinger som mulige alternative kølemidlerEn opvarmning, ventilations- og klimaanlæg (HVAC) får rengøring på en luftvåbenbase i Nigeria. Kredit:Jimmie Pike/US Air Force Mere end et dusin kemiske blandinger kunne tjene som alternative køle
Undersøgelse identificerer kemiske blandinger som mulige alternative kølemidlerEn opvarmning, ventilations- og klimaanlæg (HVAC) får rengøring på en luftvåbenbase i Nigeria. Kredit:Jimmie Pike/US Air Force Mere end et dusin kemiske blandinger kunne tjene som alternative køle -
 Identifikation af designermedicin taget af overdosispatienterLægemidler frigivet fra testpatronen (i midten) identificeres af et massespektrometer (venstre). Kredit:Greta Ren Overdosering af stoffer tager en enorm vejafgift på folkesundheden, med potente sy
Identifikation af designermedicin taget af overdosispatienterLægemidler frigivet fra testpatronen (i midten) identificeres af et massespektrometer (venstre). Kredit:Greta Ren Overdosering af stoffer tager en enorm vejafgift på folkesundheden, med potente sy -
 Udvikling af ny fotovoltaisk kommercialiseringsteknologiProfessor Jongmin Choi, Institut for Energividenskab og Teknik, DGIST. Kredit:DGIST En teknologi til yderligere at fremskynde kommercialiseringen af Colloidal Quantum Dot (CQD) fotovoltaiske (PV
Udvikling af ny fotovoltaisk kommercialiseringsteknologiProfessor Jongmin Choi, Institut for Energividenskab og Teknik, DGIST. Kredit:DGIST En teknologi til yderligere at fremskynde kommercialiseringen af Colloidal Quantum Dot (CQD) fotovoltaiske (PV -
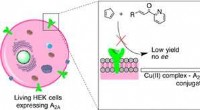 Kunstige enzymer udfører reaktioner på levende cellerKredit:American Chemical Society Naturen har udviklet tusindvis af enzymer for at lette de mange kemiske reaktioner, der finder sted inde i organismer for at opretholde liv. Nu, forskere har desig
Kunstige enzymer udfører reaktioner på levende cellerKredit:American Chemical Society Naturen har udviklet tusindvis af enzymer for at lette de mange kemiske reaktioner, der finder sted inde i organismer for at opretholde liv. Nu, forskere har desig
- Er planeter de eneste genstande i rummet, der kredser om sol?
- Hvilken civilisation eksisterede primært i en tropisk våd klimazone?
- Efter den onde kulde, her er vores tips til at varme op og samtidig holde dit miljømæssige fodaftr…
- Hvor mange liter er der i 10 US gallons?
- Etablering af oprindelsen til solmasser sorte huller og forbindelsen til mørkt stof
- Turbulensmodel kan hjælpe med at designe fly, der er i stand til at håndtere ekstreme scenarier


