Når 10,00 g bly og 1,56 gram svovlreaktion 11,56 sulfid produceres Antag, at 30,00 GO får lov til at analysere reaktionsblandingen ville vise?
forståelse af reaktionen
* bly (PB) og svovl (r) reagerer på dannelsespladesulfid (PBS). Dette er et klassisk eksempel på en kombinationsreaktion.
* loven om bevarelse af masse: Denne lov hedder det, at der ikke kan oprettes eller ødelægges i en kemisk reaktion. Den samlede masse af reaktanterne skal svare til den samlede masse af produkterne.
analyse af reaktionsblandingen
1. Begrænsende reaktant: Reaktanten, der bliver helt opbrugt i en reaktion, kaldes den begrænsende reaktant. Det dikterer, hvor meget produkt der kan dannes. For at finde dette er vi nødt til at beregne molen for hver reaktant.
* Mol Pb =(10,00 g Pb) / (207,2 g / mol Pb) =0,0483 mol Pb
* Mol s =(1,56 g s) / (32,07 g / mol s) =0,0487 mol s
Da reaktionens støkiometri er 1:1 (1 mol pb -reagerer med 1 mol S), er den begrænsende reaktant bly (PB) .
2. Teoretisk udbytte: Dette er den maksimale mængde produkt, der kan dannes baseret på den begrænsende reaktant.
* Mol PBS =0,0483 mol Pb (siden 1 mol PB producerer 1 mol PBS)
* Teoretisk udbytte af PBS =(0,0483 mol PBS) * (239,3 g/mol PBS) =11,54 g PBS
3. Faktisk udbytte: Dette er mængden af produkt, der faktisk opnås fra eksperimentet. Vi får et faktisk udbytte på 11,56 g PBS.
4. overskydende reaktant: Den reaktant, der ikke er helt brugt op, er den overskydende reaktant. I dette tilfælde er det svovl (er).
5. reaktionsblanding efter 30,00 g bly:
* Vi startede med 10,00 g bly og tilsatte 30,00 g mere, hvilket gav os i alt 40,00 g bly.
* Da vi har et stort overskud af bly, vil den begrænsende reaktant stadig være svovl (er).
* Reaktionen forbruger alle 1,56 g svovl og producerer 11,54 g blysulfid.
Derfor ville reaktionsblandingen efter tilsætning af 30,00 g bly indeholde:
* 11,54 g blysulfid (PBS) (det maksimale beløb, der kan dannes)
* 28,46 g bly (PB) (overskydende reaktant)
* ingen svovl (r) (helt konsumeret)
Vigtig note: Det teoretiske udbytte og det faktiske udbytte er meget tæt, hvilket antyder en meget effektiv reaktion.
 Varme artikler
Varme artikler
-
 Avanceret databehandling baner vej til fremtiden for NMR-spektroskopiIndbyrdes forbundne mål for materialeprojektet. Kredit:Hayes Lab Nuklear magnetisk resonans (NMR) spektroskopi hjælper kemikere og andre videnskabsmænd med at identificere og udforske atomare stru
Avanceret databehandling baner vej til fremtiden for NMR-spektroskopiIndbyrdes forbundne mål for materialeprojektet. Kredit:Hayes Lab Nuklear magnetisk resonans (NMR) spektroskopi hjælper kemikere og andre videnskabsmænd med at identificere og udforske atomare stru -
 Ny katalysator bevist effektiv i elektrosyntese af ammoniakSkematisk illustration af den syntetiske proces af Mo-SAs/AC. Kredit:GENG Jing I nyere forskning, forskere ledet af prof. Zhang Haimin fra Institute of Solid State Physics ved Hefei Institutes of
Ny katalysator bevist effektiv i elektrosyntese af ammoniakSkematisk illustration af den syntetiske proces af Mo-SAs/AC. Kredit:GENG Jing I nyere forskning, forskere ledet af prof. Zhang Haimin fra Institute of Solid State Physics ved Hefei Institutes of -
 Ny teknik til at skabe super-svampe er en game changerForskere har udtænkt nye metoder til postsyntetisk modifikation af metal-organiske rammer for at producere egenskaber i materialet, der er ideelt til gasmanipulation. Kredit:DGIST Metal-organiske
Ny teknik til at skabe super-svampe er en game changerForskere har udtænkt nye metoder til postsyntetisk modifikation af metal-organiske rammer for at producere egenskaber i materialet, der er ideelt til gasmanipulation. Kredit:DGIST Metal-organiske -
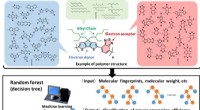 AI-software hjælper med design af nyt materiale til solcellerFig. 1. Udforskning af nye polymerer til polymersolceller ved hjælp af materialeinformatik. (Øvre) Eksempel på en polymerstruktur bestående af elektrondonor, elektronacceptor, og alkylkæder. (Mellem)
AI-software hjælper med design af nyt materiale til solcellerFig. 1. Udforskning af nye polymerer til polymersolceller ved hjælp af materialeinformatik. (Øvre) Eksempel på en polymerstruktur bestående af elektrondonor, elektronacceptor, og alkylkæder. (Mellem)
- Forskere finder potentielt manglende led i kemi, der førte til liv på Jorden
- Boeing rapporterer ingen nye jet-ordrer i januar
- Hvilken type energi har et toilet?
- Hvad er den kraft, der prøver at trække Rocket tilbage Jorden?
- Hvor mange atomer er til stede i 4,0 mol?
- Hawaii vulkan lava ødelægger hundredvis af hjem natten over


