Hvorfor er regnvand syrligt, men havvand grundlæggende?
regnvand:
* Naturlig surhed: Rent regnvand er let surt på grund af opløst kuldioxid (CO2) fra atmosfæren. CO2 reagerer med vand til dannelse af kulsyre (H2CO3), hvilket resulterer i en pH -værdi på ca. 5,6.
* sur regn: Menneskelige aktiviteter, såsom forbrænding af fossile brændstoffer, frigiver svovldioxid (SO2) og nitrogenoxider (NOX) i atmosfæren. Disse gasser reagerer med vand for at danne svovlsyre (H2SO4) og salpetersyre (HNO3), hvilket gør regnvand mere surt. Dette er kendt som surt regn, og det kan have skadelige virkninger på miljøet.
Havvand:
* opløste salte: Havvand indeholder høje niveauer af opløste salte, herunder natriumchlorid (NaCI), magnesiumchlorid (MGCL2) og calciumsulfat (CASO4). Disse salte bidrager til den lidt basale pH for havvand.
* carbonatbufferingssystem: Havet indeholder et naturligt bufferingssystem baseret på interaktion mellem kulsyre, bicarbonationer (HCO3-) og carbonationer (CO32-). Dette system hjælper med at moderere ændringer i pH, hvilket holder havet relativt stabilt.
* Biologiske processer: Marine organismer, såsom koraller, alger og fytoplankton, frigiver calciumcarbonat (CACO3), som bidrager til alkaliniteten af havvand.
Kortfattet:
* regnvand: Lidt surt på grund af opløst CO2 og surt regn.
* Havvand: Lidt basisk på grund af opløste salte, et carbonatbufferingssystem og biologiske processer.
Det er vigtigt at bemærke, at både regnvand og havvand har et smalt pH -område, hvilket betyder, at de ikke er ekstremt sure eller basale. Ændringer i surhed eller alkalinitet af begge kan imidlertid have betydelige miljøpåvirkninger.
 Varme artikler
Varme artikler
-
 En ny fluorescerende probe, der kan skelne B-celler fra T-cellerFigur 1. A) Splenocytter blev isoleret fra musemilt, og T- og B -celler blev adskilt ved anvendelse af magnetisk aktiveret cellesortering (MACS). Cellerne blev efterfølgende udpladet i 384 brønde og o
En ny fluorescerende probe, der kan skelne B-celler fra T-cellerFigur 1. A) Splenocytter blev isoleret fra musemilt, og T- og B -celler blev adskilt ved anvendelse af magnetisk aktiveret cellesortering (MACS). Cellerne blev efterfølgende udpladet i 384 brønde og o -
 Plast er ikke hvad vi tror. Ny undersøgelse finder ud af, at de er en smule gummiagtige, baner veje…Illustration af skabelsen af grænsefladetransientelastomerdomæne ved overfladen via den segmentelle dynamiske gradient, ved at anvende et repræsentativt simuleringssnapshot (gengivet i VMD37). Den e
Plast er ikke hvad vi tror. Ny undersøgelse finder ud af, at de er en smule gummiagtige, baner veje…Illustration af skabelsen af grænsefladetransientelastomerdomæne ved overfladen via den segmentelle dynamiske gradient, ved at anvende et repræsentativt simuleringssnapshot (gengivet i VMD37). Den e -
 Ramme for undersøgelse af ozonniveauer på realistiske indendørs overfladerGrafisk abstrakt. Kredit:Environmental Science &Technology (2022). DOI:10.1021/acs.est.1c08040 Et forskningssamarbejde ledet af Penn State havde til formål at forbedre forståelsen af indendørs oz
Ramme for undersøgelse af ozonniveauer på realistiske indendørs overfladerGrafisk abstrakt. Kredit:Environmental Science &Technology (2022). DOI:10.1021/acs.est.1c08040 Et forskningssamarbejde ledet af Penn State havde til formål at forbedre forståelsen af indendørs oz -
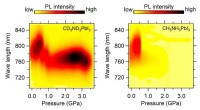 Jo tungere, jo bedre - overlegen stabilitet i isotopfunktionaliserede perovskitterFarveplot af de trykafhængige PL-udviklinger af CD3ND3PbI3 (venstre) og CH3NH3PbI3 (højre) enkeltkrystaller. Kredit:Gang Liu Organisk-uorganisk hybrid blyiodidperovskiter er universelt anerkendt s
Jo tungere, jo bedre - overlegen stabilitet i isotopfunktionaliserede perovskitterFarveplot af de trykafhængige PL-udviklinger af CD3ND3PbI3 (venstre) og CH3NH3PbI3 (højre) enkeltkrystaller. Kredit:Gang Liu Organisk-uorganisk hybrid blyiodidperovskiter er universelt anerkendt s


