Hvad er struktur af svovlmonochlorid S2CL2?
* molekylær geometri: bøjet (Ligner vand, H₂O).
* obligationsvinkler: Cirka 103 ° (lidt mindre end den ideelle tetrahedrale vinkel på 109,5 °).
* Hybridisering: Svovlatomerne er sp³ hybridiserede .
* binding: Hvert svovlatom danner en enkeltbinding med det andet svovlatom og en enkelt binding med hvert kloratom.
Her er en sammenbrud af strukturen:
1. Centralatom: Der er to svovlatomer i midten af molekylet.
2. Omgivende atomer: Hvert svovlatom er bundet til det ene kloratom og det andet svovlatom.
3. ensomme par: Hvert svovlatom har to ensomme par elektroner.
Repræsentation:
Du kan repræsentere strukturen på forskellige måder:
* Lewis -struktur: Dette viser bindings- og ensomme par som prikker.
* ball-and-stick model: Dette viser atomerne som kugler og bindingerne som pinde.
* Rumfyldningsmodel: Dette viser de relative størrelser af atomerne og den overordnede form af molekylet.
Bemærk: Den bøjede form af S₂cl₂ opstår på grund af frastødningen mellem de ensomme par på svovlatomerne.
Sidste artikelHvorfor fluor danner negative ioner?
Næste artikelHvordan beregner du hvor mange iltatomer der er i 2,50 gram gas?
 Varme artikler
Varme artikler
-
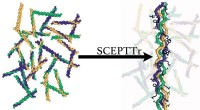 Kollagenstrukturer får den kongelige afsløringEn algoritme af forskere fra Rice University forudsiger strukturer og smeltetemperaturer af kollagen, den tredobbelte spiral, der tegner sig for omkring en tredjedel af kroppens proteiner og danner fi
Kollagenstrukturer får den kongelige afsløringEn algoritme af forskere fra Rice University forudsiger strukturer og smeltetemperaturer af kollagen, den tredobbelte spiral, der tegner sig for omkring en tredjedel af kroppens proteiner og danner fi -
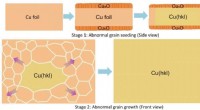 Indstilling af overfladen giver variationer til metalfolierDannelsesmekanisme for store krystallinske Cu -folier med forskellige overflader via annealering af peroxid -Cu -folier. Kredit:IBS Ligesom kloning i biologi muliggør oprettelse af en eller flere
Indstilling af overfladen giver variationer til metalfolierDannelsesmekanisme for store krystallinske Cu -folier med forskellige overflader via annealering af peroxid -Cu -folier. Kredit:IBS Ligesom kloning i biologi muliggør oprettelse af en eller flere -
 Prisbillig og mobil rensning af dialysevandI dag, Hæmodialyse er ofte centerbaseret og griber dybt ind i patienternes hverdag. Ved hjælp af mobile vandkilder, vi kunne tage et skridt mod højere mobilitet. Kredit:Fraunhofer IZI/Dr. Rainer Golda
Prisbillig og mobil rensning af dialysevandI dag, Hæmodialyse er ofte centerbaseret og griber dybt ind i patienternes hverdag. Ved hjælp af mobile vandkilder, vi kunne tage et skridt mod højere mobilitet. Kredit:Fraunhofer IZI/Dr. Rainer Golda -
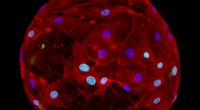 Gel dråber til regenerativ medicinCellebærende geler lavet af selvsamlende ultrakorte peptider kan producere menneskelignende væv, der kan bruges til regenerative terapier. Kredit:KAUST; Gustavo Ramirez Calderon Geldråber i mikrom
Gel dråber til regenerativ medicinCellebærende geler lavet af selvsamlende ultrakorte peptider kan producere menneskelignende væv, der kan bruges til regenerative terapier. Kredit:KAUST; Gustavo Ramirez Calderon Geldråber i mikrom
- Hvad er to måder, hvorpå et objekt kan accelerere?
- Hvor lang tid tager det for månen at krydse himlen fra Moon-Rise Moon-sæt?
- Hvad er lighederne i bevægelse af et frit faldende objekt og en der projiceres vandret?
- Hvad er referencerammen for et fly, der bevæger sig 500 km?
- Et phosphoratom omgivet af fire iltatomer kaldes kombomly A?
- Hvad er typen af lava i sammensatte vulkaner?


