Hvorfor fluor danner negative ioner?
* Høj elektronegativitet: Fluor er det mest elektronegative element på den periodiske tabel. Dette betyder, at det har en stærk attraktion for elektroner.
* lille atomstørrelse: Fluor har en lille atomradius, hvilket betyder, at dens kerne er relativt tæt på den yderste elektronskal. Dette resulterer i en stærk elektrostatisk tiltrækning mellem kernen og elektronerne.
* Kun en elektron væk fra en fuld oktet: Fluor har kun brug for endnu en elektron for at opnå en stabil, ædelgaskonfiguration (som neon). Dette gør det at få en elektron meget energisk gunstig.
Processen:
Når fluor reagerer med et andet element, accepterer det let en elektron og danner en fluorion (F⁻). Denne proces frigiver energi, hvilket gør reaktionen eksoterm og energisk gunstig.
Eksempel:
I dannelsen af natriumfluorid (NAF) mister natrium (Na) et elektron for at blive en natriumion (Na⁺), mens fluorvinder, at elektronet bliver en fluorion (F⁻). Den resulterende ioniske binding mellem Na⁺ og F⁻ er det, der holder forbindelsen sammen.
Kortfattet: Fluorens høje elektronegativitet, lille størrelse og ønske om en fuld oktet gør det meget sandsynligt, at det får en elektron og danner en negativ ion.
Sidste artikelHvad er formlen for jern og nitrat?
Næste artikelHvad er struktur af svovlmonochlorid S2CL2?
 Varme artikler
Varme artikler
-
 Radikal afsaltningstilgang kan forstyrre vandindustrienIllustration, der beskriver ferskvandsproduktion fra hypersalinlake ved ekstraktion af temperatursvingende opløsningsmidler. Kredit:Chanhee Boo/Columbia Engineering Hypersalin saltlage - vand, der
Radikal afsaltningstilgang kan forstyrre vandindustrienIllustration, der beskriver ferskvandsproduktion fra hypersalinlake ved ekstraktion af temperatursvingende opløsningsmidler. Kredit:Chanhee Boo/Columbia Engineering Hypersalin saltlage - vand, der -
 Vi komposterede bionedbrydelige balloner. Her er hvad vi fandt efter 16 ugerBionedbrydelige balloner efter 16 uger i ferskvand. Kredit:Jesse Benjamin, Forfatter angivet Efter 16 uger i en industriel kompostbunke, vi udgravede blå og hvide balloner og fandt dem helt uskadt
Vi komposterede bionedbrydelige balloner. Her er hvad vi fandt efter 16 ugerBionedbrydelige balloner efter 16 uger i ferskvand. Kredit:Jesse Benjamin, Forfatter angivet Efter 16 uger i en industriel kompostbunke, vi udgravede blå og hvide balloner og fandt dem helt uskadt -
 Nanokrystallinske materialer med reduceret ilt viser forbedret ydeevnePostdoktorforsker Peiman Shahbegi-Roodposhti og en bachelorstuderende i materialevidenskab arbejder med en handskekasse for at producere nanomaterialer. Kredit:University of Connecticut Forskere v
Nanokrystallinske materialer med reduceret ilt viser forbedret ydeevnePostdoktorforsker Peiman Shahbegi-Roodposhti og en bachelorstuderende i materialevidenskab arbejder med en handskekasse for at producere nanomaterialer. Kredit:University of Connecticut Forskere v -
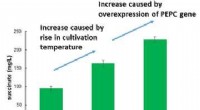 Verdens mest effektive produktion af succinat fra kuldioxidFigur 1:Øgede mængder succinat produceres baseret på overekspression af PEPC -gener og forhøjelse af dyrkningstemperaturen. Kredit:Kobe University Succinat bruges i vid udstrækning som en rå ingre
Verdens mest effektive produktion af succinat fra kuldioxidFigur 1:Øgede mængder succinat produceres baseret på overekspression af PEPC -gener og forhøjelse af dyrkningstemperaturen. Kredit:Kobe University Succinat bruges i vid udstrækning som en rå ingre
- Hvad er der i kernen?
- Hvad er kvantiseringsområde?
- Hvilken gruppe af metaller er de bedste ledere varme og elektrisk strøm?
- Hvad er den ultimative energikilde for næsten al organisme undtagen dem, der bor dybt i havet nær …
- Ja, men ikke sådan! Hvorfor byfortætning ofte mangler offentlig accept
- Franklin-ovnens udvikling:Fra opfindelse til moderne effektivitet


