Hvorfor er CASO4 mindre opløselig i vand end NaCl?
1. Gitter Energi:
* caso₄: Calcium- og sulfationer har en stærk elektrostatisk tiltrækning på grund af deres høje ladninger (+2 for calcium, -2 for sulfat). Denne stærke attraktion skaber en meget stabil krystalgitter med høj gitterenergi.
* NaCl: Natrium- og chloridioner har lavere ladninger (+1 for natrium, -1 for chlorid). Den elektrostatiske tiltrækning er svagere, hvilket resulterer i en lavere gitterenergi.
2. Hydratiseringsenergi:
* caso₄: Mens vandmolekyler kan omringe ionerne og hydratere dem, er hydratiseringsenergien (energi frigivet, når ioner er omgivet af vandmolekyler) ikke nok til at overvinde caso₄s stærke gitterenergi.
* NaCl: NACL's nedre gitterenergi gør det muligt for hydratiseringsenergien at være tilstrækkelig til at bryde de ioniske bindinger og opløse krystalgitteret.
3. Ion-dipol-interaktioner:
* caso₄: Den større størrelse af sulfationen og den høje ladningstæthed gør det sværere for vandmolekyler at effektivt interagere med sulfationen. Denne svagere interaktion begrænser yderligere opløselighed.
* NaCl: Mindre ioner som natrium og chlorid giver mulighed for stærkere ion-dipol-interaktioner med vandmolekyler, der fremmer opløsning.
Kortfattet:
Den stærke gitterenergi fra Caso₄ kombineret med sin svagere hydratiseringsenergi og ion-dipol-interaktioner med vand resulterer i en meget lavere opløselighed sammenlignet med NaCI.
Sidste artikelNår magnesium brænder luft, hvilket stof dannes?
Næste artikelHvad er sammensat blanding?
 Varme artikler
Varme artikler
-
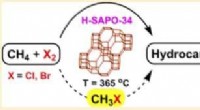 At reducere fodaftrykket af en drivhusgas, der er mere potent end kuldioxidUSC-forskere brugte H-SAPO-34 til direkte at omdanne metan til ethylen og propylen. Kredit:G. K. Surya Prakash USC-forskere har låst op for en ny, mere effektiv vej til at omdanne metan - en poten
At reducere fodaftrykket af en drivhusgas, der er mere potent end kuldioxidUSC-forskere brugte H-SAPO-34 til direkte at omdanne metan til ethylen og propylen. Kredit:G. K. Surya Prakash USC-forskere har låst op for en ny, mere effektiv vej til at omdanne metan - en poten -
 Undersøgelse afslører videnskaben bag traditionel mezcal-fremstillingsteknikKredit:Unsplash/CC0 Public Domain Håndværksproducenter af mezcal har en afprøvet og sand måde at fortælle, hvornår drikken er blevet destilleret til det rigtige alkoholniveau. De sprøjter lidt ned
Undersøgelse afslører videnskaben bag traditionel mezcal-fremstillingsteknikKredit:Unsplash/CC0 Public Domain Håndværksproducenter af mezcal har en afprøvet og sand måde at fortælle, hvornår drikken er blevet destilleret til det rigtige alkoholniveau. De sprøjter lidt ned -
 Nyt open source-websted indeholder tegninger til lab-on-a-chip-enhederMetafludics.org, et nyt MIT open source-websted, leverer tegninger til mikrofluidiske dele. På billedet er et par billeder fra hjemmesiden. Kredit:Metafludics.org Et nyt MIT-designet open source-w
Nyt open source-websted indeholder tegninger til lab-on-a-chip-enhederMetafludics.org, et nyt MIT open source-websted, leverer tegninger til mikrofluidiske dele. På billedet er et par billeder fra hjemmesiden. Kredit:Metafludics.org Et nyt MIT-designet open source-w -
 Forskere efterligner neuralt vævNyt banebrydende materiale kan føre til fremtidig autonom blød robotteknologi, dobbelte sensorer og aktuatorer til bløde eksoskeletter, eller kunstigt skind. Kredit:U.S. Army Research Laboratory U
Forskere efterligner neuralt vævNyt banebrydende materiale kan føre til fremtidig autonom blød robotteknologi, dobbelte sensorer og aktuatorer til bløde eksoskeletter, eller kunstigt skind. Kredit:U.S. Army Research Laboratory U
- Hvor mange bor lavede kontrolstang, der blev brugt under nuklear reaktion?
- Hvordan ville du beregne den kinetiske energi på en 0,148 kg baseball, der rejser 90 mph?
- Struktur af ny form for superhårdt kulstof identificeret
- Hvilke energitransformationer forekommer i en bil?
- At spille spil med kvanteinterferens
- Separat, men ulige:NYU Metro Center Report undersøger segregation i NYC-skoler


