Hvad har et højere kogepunkt NaCl eller Cl2?
Her er hvorfor:
* ionisk binding: NaCl er en ionisk forbindelse, hvilket betyder, at den dannes af den elektrostatiske tiltrækning mellem positivt ladede natriumioner (Na⁺) og negativt ladede chloridioner (CL⁻). Disse stærke ioniske bindinger kræver en stor mængde energi for at bryde, hvilket resulterer i et højt kogepunkt (1413 ° C).
* kovalent binding: Cl₂ er en kovalent forbindelse, hvilket betyder, at den dannes ved deling af elektroner mellem to kloratomer. Disse kovalente bindinger er svagere end ioniske bindinger. Klorgas har et meget lavere kogepunkt (-34,04 ° C), fordi der er behov for mindre energi for at overvinde de svagere intermolekylære kræfter, der holder molekylerne sammen.
Kortfattet: Typen af binding mellem atomer har en betydelig indflydelse på kogepunktet. Ioniske forbindelser som NaCI har meget højere kogepunkter på grund af de stærke elektrostatiske attraktioner mellem ioner, mens kovalente forbindelser som Cl₂ har lavere kogepunkter på grund af svagere intermolekylære kræfter.
Sidste artikelHvor mange valensskaller har fluor?
Næste artikelNår magnesium brænder luft, hvilket stof dannes?
 Varme artikler
Varme artikler
-
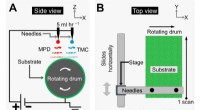 Forskere skaber omvendt osmose-membraner med justerbar tykkelseEn skematisk illustration - både ovenfra og fra siden - af 3-D-udskrivning elektrospray-processen, der blev brugt til at skabe ekstremt glatte tyndfilmskompositmembraner, der blev udviklet i McCutcheo
Forskere skaber omvendt osmose-membraner med justerbar tykkelseEn skematisk illustration - både ovenfra og fra siden - af 3-D-udskrivning elektrospray-processen, der blev brugt til at skabe ekstremt glatte tyndfilmskompositmembraner, der blev udviklet i McCutcheo -
 Et nyt værktøj til at tænde og slukke for proteinerDennis Eickelbeck (til venstre) og Stefan Herlitze analyserer lysfølsomme proteiner. Kredit:RUB, Kramer Proteiner kan styres med lys af forskellige bølgelængder. endda flere på én gang takket være
Et nyt værktøj til at tænde og slukke for proteinerDennis Eickelbeck (til venstre) og Stefan Herlitze analyserer lysfølsomme proteiner. Kredit:RUB, Kramer Proteiner kan styres med lys af forskellige bølgelængder. endda flere på én gang takket være -
 Forskere diversificerer mulighederne for lægemiddeludvikling med ny metalkatalysatorKemi professor M. Christina White, ret, og kandidatstuderende Jinpeng Zhao udviklede en ny katalysator, der har potentialet til at fremme tempoet og effektiviteten af lægemiddeludvikling. Kredit:Fre
Forskere diversificerer mulighederne for lægemiddeludvikling med ny metalkatalysatorKemi professor M. Christina White, ret, og kandidatstuderende Jinpeng Zhao udviklede en ny katalysator, der har potentialet til at fremme tempoet og effektiviteten af lægemiddeludvikling. Kredit:Fre -
 Forskere skaber syntetisk prototissue, der kan synkroniseresOpdagelsen, udgivet i Naturmaterialer , er den første kemisk programmerede tilgang til fremstilling af et kunstigt væv. Fundene, som kan have store sundhedsmæssige anvendelser i fremtiden, kunne se
Forskere skaber syntetisk prototissue, der kan synkroniseresOpdagelsen, udgivet i Naturmaterialer , er den første kemisk programmerede tilgang til fremstilling af et kunstigt væv. Fundene, som kan have store sundhedsmæssige anvendelser i fremtiden, kunne se


