Hvorfor smeltet svovl udfører elektricitet, men kobberchlorid kan?
smeltet svovl:
* ikke-metallisk: Svovl er en ikke-metal. Ikke-metaller udfører generelt ikke elektricitet godt, selv i deres flydende tilstand.
* Ingen gratis elektroner: Svovlatomer holder fast på deres elektroner tæt. Når svovl smeltes, danner det ikke ioner eller frigiver frie elektroner, der kan bære en elektrisk strøm.
fast kobberchlorid (CUCL):
* ionisk forbindelse: Kobberchlorid er en ionisk forbindelse. Dette betyder, at det er dannet af positivt ladede kobberioner (Cu+) og negativt ladede chloridioner (Cl-).
* ioner kan flytte: I fast tilstand er disse ioner arrangeret i et krystallinsk gitter. Mens de holdes i faste positioner, kan de stadig vibrere.
* Konduktivitet: Når der anvendes et elektrisk potentiale, kan ionerne flytte deres positioner lidt, hvilket giver mulighed for strømmen af elektrisk strøm. Dette kaldes ionisk ledningsevne .
Sammendrag:
* smeltet svovl: Leder ikke elektricitet, fordi det mangler frie elektroner eller ioner.
* fast kobberchlorid: Udfører elektricitet på grund af bevægelsen af dens ioner inden for dens krystallinske struktur.
Vigtig note: Kobberchlorid i dets * smeltede tilstand * ville være en meget bedre leder end i sin solide tilstand, fordi ionerne ville være i stand til at bevæge sig mere frit.
Sidste artikelHvor mange atomer er der i elementet ilt?
Næste artikelHvad er den kemiske formel for brintchlorat?
 Varme artikler
Varme artikler
-
 Video:Kan vi gøre opioider mindre vanedannende?Kredit:The American Chemical Society Opioider er de mest kraftfulde smertestillende midler, vi har, men de er utroligt vanedannende. Titusindvis af mennesker i USA dør af en opioidoverdosis hvert
Video:Kan vi gøre opioider mindre vanedannende?Kredit:The American Chemical Society Opioider er de mest kraftfulde smertestillende midler, vi har, men de er utroligt vanedannende. Titusindvis af mennesker i USA dør af en opioidoverdosis hvert -
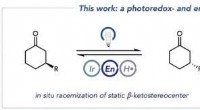 Forskere rapporterer om ny platform for stereokontrolDen overordnede transformation, der kombinerer racemisering af ketonsubstraterne (til venstre) med biokatalytisk reduktion til enantiomert rene alkoholprodukter (i midten), og den vigtigste enaminylra
Forskere rapporterer om ny platform for stereokontrolDen overordnede transformation, der kombinerer racemisering af ketonsubstraterne (til venstre) med biokatalytisk reduktion til enantiomert rene alkoholprodukter (i midten), og den vigtigste enaminylra -
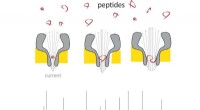 Nanoporer gør det bærbare massespektrometer til peptider til virkelighedEt peptid kommer ind i den tynde ende af nanoporen, og der ændrer strømmen i forhold til dens masse. Ved at bruge forskellig størrelse nanoporer, en række peptidstørrelser kan måles. Kredit:G. Maglia
Nanoporer gør det bærbare massespektrometer til peptider til virkelighedEt peptid kommer ind i den tynde ende af nanoporen, og der ændrer strømmen i forhold til dens masse. Ved at bruge forskellig størrelse nanoporer, en række peptidstørrelser kan måles. Kredit:G. Maglia -
 Ny polymermembranteknologi forbedrer effektiviteten af kuldioxidopsamlingKredit:Unsplash/CC0 Public Domain Forskere har udviklet en ny membranteknologi, der muliggør mere effektiv fjernelse af kuldioxid (CO2 ) fra blandede gasser, såsom emissioner fra kraftværker. For
Ny polymermembranteknologi forbedrer effektiviteten af kuldioxidopsamlingKredit:Unsplash/CC0 Public Domain Forskere har udviklet en ny membranteknologi, der muliggør mere effektiv fjernelse af kuldioxid (CO2 ) fra blandede gasser, såsom emissioner fra kraftværker. For
- Hvad er de strukturer, der tiltrækker insekter og andre pollinatorer til en blomst?
- Hvis en dig er til stede inden for rock outcrop, hvad dets aldersforhold til de andre lag?
- Gennembrud muliggør lagring og frigivelse af mekaniske bølger uden energitab
- Hvilken type formørkelse varer den længste?
- Sådan beregnes wellvolumes
- Sådan læses en vandbarometer


