Forskere rapporterer om ny platform for stereokontrol
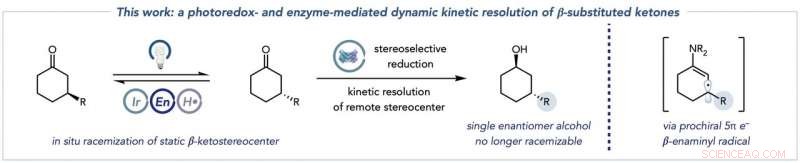
Den overordnede transformation, der kombinerer racemisering af ketonsubstraterne (til venstre) med biokatalytisk reduktion til enantiomert rene alkoholprodukter (i midten), og den vigtigste enaminylradikalart, som denne kemi låser op for at muliggøre racemisering af typisk statiske β-ketostereocentre (til højre). Kredit:Jacob DeHovitz
Et samarbejde mellem to laboratorier ved Princeton University's Department of Chemistry har givet en slående ny platform, der giver kemikere mulighed for at genfortolke reglerne for stereokemi og stereokontrol med vigtige implikationer for den farmaceutiske og agrokemiske industri.
Forskningen viser fotoredox-katalyses evne til at tage traditionelt statiske stereocentre og gøre dem dynamiske ved kontinuerligt og kontrollerbart at bryde og gendanne molekylære bindinger. Det viser lovende for videnskabsmænd at sætte stereocentrene for en kompleks målforbindelse i en kortfattet form, effektivt trin frem for et stereocenter ad gangen. (Et stereocenter giver et molekyle spejlbillede-asymmetri, hvilket er vigtigt ved bestemmelse af biologisk aktive egenskaber under syntese.)
Samarbejdet parrer ekspertise fra MacMillan-laboratoriet og Hyster-laboratoriet. Papiret, "Statisk til inducerbart dynamisk stereokontrol:den konvergerende brug af racemiske β-substituerede ketoner, " vises i Videnskab denne uge.
"Normalt, når du tænker på at bygge molekyler med stereocentre i dem, du tænker på at sætte stereocentret i den bindingsdannende begivenhed, " sagde Todd Hyster, adjunkt i kemi. "Og hvad vi har fundet er, at hvis du bruger fotoredox-katalyse, du kan i det væsentlige låse op for mekanismer til at lave stereocentre, der ellers ville være statiske, eller fast. Du kan gøre dem dynamiske.
"Når du kobler dem med meget selektive enzymer, du kan tænke på at bygge stereokemisk komplekse molekyler på helt nye måder."
Stereokemi involverer det rumlige arrangement af atomer, og hvordan de kan manipuleres i den molekylære struktur til ønskede resultater. Det stammer fra det faktum, at carbon har fire substituenter. Disse fire substituenter er forskellige; de skal eksistere som spejlbilleder af hinanden. Disse spejlbilleder kaldes enantiomerer. Vores hænder er enantiomerer, for eksempel; de er spejlbilleder af hinanden. Hvad det praktisk talt betyder er, at de ikke kan overlejres - en venstre handske passer ikke på en højre hånd.
Den menneskelige krop reagerer på medicin på nøjagtig samme måde. Vores biologiske stof består af den ene serie af spejlbilleder og ikke den anden. Kroppen kan genkende forskellen mellem to lægemidler, der virker identiske, selvom den ene er et spejlbillede, og den anden ikke er det. Denne anerkendelse påvirker optagelsen og dermed effektiviteten af terapier.
Hvad MacMillan og Hyster-forskningen afslørede, er en måde at afkoble stereocentrets konfiguration fra det trin, hvor det dannes, eller racemiseret. At være i stand til at kontrollere denne racemisering er vigtig for udviklingen af de mest effektive lægemidler.
"Der er mange, mange grunde til, at dette er spændende forskning, ikke mindst, hvoraf du dybest set kan lave et molekyle, og du kan sige, måske ville jeg rigtig gerne ændre det stereocenter for at gøre det til noget andet. Du kan faktisk gå tilbage og gøre det, " sagde David MacMillan, James S. McDonnell Distinguished University Professor of Kemi. "Dette er noget, som vi ikke tror, er blevet gjort på denne måde før i organisk kemi, og så det åbner nogle bemærkelsesværdige muligheder."
Enzymer booster resultaterne
Det var introduktionen af meget selektive enzymer i processen, der drev undersøgelsens fremskridt fra "B+ til A+"-forskning, sagde MacMillan.
"Enzymer har denne måde at være i stand til at give det, der kaldes stereokontrol, eller at introducere meget specifikke former til kemi, som almindelige katalysatorer bare ikke kan, " sagde han. "Ved at bringe disse to ideer sammen, det tillader en helt ny tilgang til, hvordan man bygger stereokemi."
Der sker meget under motorhjelmen i denne proces. Når videnskabsmænd syntetiserer en forbindelse med flere stereocentre, de gør den antagelse, at centret ikke kan vende eller blive dynamisk, når det først er "indstillet". Molekyler syntetiseres sekventielt:der dannes et center, og så er den låst; og så dannes en anden, og så er den låst, og så videre.
Jacob DeHovitz, en femteårs kandidatstuderende i Hyster-laboratoriet og hovedforfatter på papiret, forklaret, hvordan reaktionen beskrevet i denne forskning gør det muligt for forskere at låse op for denne indstilling.
Der er to vigtige dele af reaktionen. I første halvleg, to nøglearter dannes ud fra et ketonudgangsmateriale. Den første art kaldes enamin, nøglen, fordi den kan målrettes af photoredox-katalysatoren. En anden art - et enaminylradikal - er et resultat af dette trin, og ødelægger det originale molekylære stereocenter og opretter det næste trin i processen.
"Den anden halvdel er den biokatalytiske reaktion. Enzymet i opløsning - i dette tilfælde, hovedsageligt ketoreduktaser - reducerer en af disse ketonenantiomerer, som igen konstant racemiserer i opløsning, at danne et alkoholprodukt, der ikke kan undergå racemisering under vores forhold. Kritisk, den anden ketonenantiomer reagerer ikke med ketoreduktasen, fordi den ikke kan passe ind i enzymets aktive sted. Denne skævhed for én enantiomer er vigtig, fordi den forhindrer ketoreduktasen i den uønskede dannelse af andre alkoholstereoisomerer.
"Hvis den biokatalytiske reaktion kombineres med de nye racemiseringsbetingelser, hvor udgangsmaterialets enantiomerer konstant racemiserer, så har en kemiker teoretisk råd til op til 100 % af det ønskede produkt, fordoble effektiviteten, " sagde DeHovitz.
Denne forskning repræsenterer tre års samarbejde mellem de to laboratorier.
 Varme artikler
Varme artikler
-
 Simple entropier for komplicerede molekylerGrafisk abstrakt. Kredit:Beregning af absolutte molekylære entropier og varmekapaciteter gjort enkel, Kemisk Videnskab (2021). DOI:10.1039/D1SC00621E Kemikere fra universitetet i Bonn udviklede
Simple entropier for komplicerede molekylerGrafisk abstrakt. Kredit:Beregning af absolutte molekylære entropier og varmekapaciteter gjort enkel, Kemisk Videnskab (2021). DOI:10.1039/D1SC00621E Kemikere fra universitetet i Bonn udviklede -
 Team får indsigt i oxidlaget af rustfrit stålFra venstre, Lin Zhu, beamline videnskabsmand; Alexei Zakharov, MAXPEEM beamline manager; Axel Knutsson, Materialespecialist hos Alfa Laval; Oskar Darselius Berg, Alfa Laval. Kredit:Lunds Universitet
Team får indsigt i oxidlaget af rustfrit stålFra venstre, Lin Zhu, beamline videnskabsmand; Alexei Zakharov, MAXPEEM beamline manager; Axel Knutsson, Materialespecialist hos Alfa Laval; Oskar Darselius Berg, Alfa Laval. Kredit:Lunds Universitet -
 Forsker kortlægger kæmpe virusKristin Parent kortlagde strukturen af den gigantiske Samba-virus med MSUs kryo-EM-mikroskop, som er omtalt på forsiden af bladet Virus . Kredit:Michigan State University I et laboratorium v
Forsker kortlægger kæmpe virusKristin Parent kortlagde strukturen af den gigantiske Samba-virus med MSUs kryo-EM-mikroskop, som er omtalt på forsiden af bladet Virus . Kredit:Michigan State University I et laboratorium v -
 Rensning af pollenskallerKredit:American Chemical Society Efterhånden som allergisæsonen intensiveres, mange mennesker forbander pollen - det pulveragtige stof, der frigives af planter til reproduktion. Imidlertid, pollen
Rensning af pollenskallerKredit:American Chemical Society Efterhånden som allergisæsonen intensiveres, mange mennesker forbander pollen - det pulveragtige stof, der frigives af planter til reproduktion. Imidlertid, pollen


