Hvad er den molære masse af tetramethylammoniumiodid?
1. Identificer den kemiske formel:
Tetramethylammoniumiodid har formlen (CH₃) ₄ni.
2. Bestem den molære masse for hvert element:
* Carbon (c):12,01 g/mol
* Hydrogen (H):1,01 g/mol
* Nitrogen (n):14,01 g/mol
* Jod (I):126,90 g/mol
3. Beregn den samlede molmasse:
* carbon: 4 c atomer * 12,01 g/mol/c =48,04 g/mol
* brint: 12 timer atomer * 1,01 g/mol/h =12,12 g/mol
* nitrogen: 1 n atom * 14,01 g/mol/n =14,01 g/mol
* jod: 1 I atom * 126,90 g/mol/i =126,90 g/mol
4. Tilføj de molære masser af alle elementer:
48,04 g/mol + 12,12 g/mol + 14,01 g/mol + 126,90 g/mol = 201,07 g/mol
Derfor er den molære masse af tetramethylammoniumiodid 201,07 g/mol.
Sidste artikelHvordan er hydrogenperoxid nedbrudt?
Næste artikelHvor mange atomer af fluor er der i et molekylært carbontetrafluorid?
 Varme artikler
Varme artikler
-
 Porøse krystaller binder fluorholdige drivhusgasserI baggrunden:lysmikroskopibilleder af enkeltkrystalstrukturerne af den formfaste organiske burforbindelse. Foran:kugle-og-stik-model af enkeltkrystalstrukturen, grå:kulstof, hvid:brint, rød:oxygen, bl
Porøse krystaller binder fluorholdige drivhusgasserI baggrunden:lysmikroskopibilleder af enkeltkrystalstrukturerne af den formfaste organiske burforbindelse. Foran:kugle-og-stik-model af enkeltkrystalstrukturen, grå:kulstof, hvid:brint, rød:oxygen, bl -
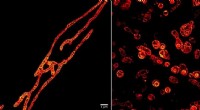 Levende mitokondrier set i hidtil usete detaljer:fotoblegning i STED-mikroskopi overvundetIndre membraner af levende mitokondrier under et STED-mikroskop afbildet ved hjælp af MitoPB Yellow fluorescerende markørmolekyle skabt af forskere ved Institute of Transformative Bio-Molecules (ITbM)
Levende mitokondrier set i hidtil usete detaljer:fotoblegning i STED-mikroskopi overvundetIndre membraner af levende mitokondrier under et STED-mikroskop afbildet ved hjælp af MitoPB Yellow fluorescerende markørmolekyle skabt af forskere ved Institute of Transformative Bio-Molecules (ITbM) -
 Identifikation af designermedicin taget af overdosispatienterLægemidler frigivet fra testpatronen (i midten) identificeres af et massespektrometer (venstre). Kredit:Greta Ren Overdosering af stoffer tager en enorm vejafgift på folkesundheden, med potente sy
Identifikation af designermedicin taget af overdosispatienterLægemidler frigivet fra testpatronen (i midten) identificeres af et massespektrometer (venstre). Kredit:Greta Ren Overdosering af stoffer tager en enorm vejafgift på folkesundheden, med potente sy -
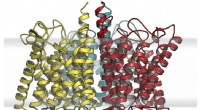 Biokemikere viser, hvordan evolutionen kombinerer en næringsstofsensor fra eksisterende grundstoffe…Hypotetisk udvidet model af anammox ammoniumsensorproteinet. Kredit:Susana Andrade Et hold ledet af Freiburg biokemikeren prof. Dr. Susana Andrade har karakteriseret et protein, der gør det muligt
Biokemikere viser, hvordan evolutionen kombinerer en næringsstofsensor fra eksisterende grundstoffe…Hypotetisk udvidet model af anammox ammoniumsensorproteinet. Kredit:Susana Andrade Et hold ledet af Freiburg biokemikeren prof. Dr. Susana Andrade har karakteriseret et protein, der gør det muligt
- Hvad er funktionen af toksicitet?
- Orkanen Henri rammer ned på den amerikanske østkyst
- Hvad er formålet med ringe omkring en MC-312 Corrosives tankskib?
- Har Jorden radioaktiv intern energi og ekstern energi?
- Plutos hjerte kan være koldt som is, men det er på det rigtige sted ifølge forskning
- Wimbledon omarbejder AI-teknologi for at reducere skævhed i spilhøjdepunkter


