Levende mitokondrier set i hidtil usete detaljer:fotoblegning i STED-mikroskopi overvundet
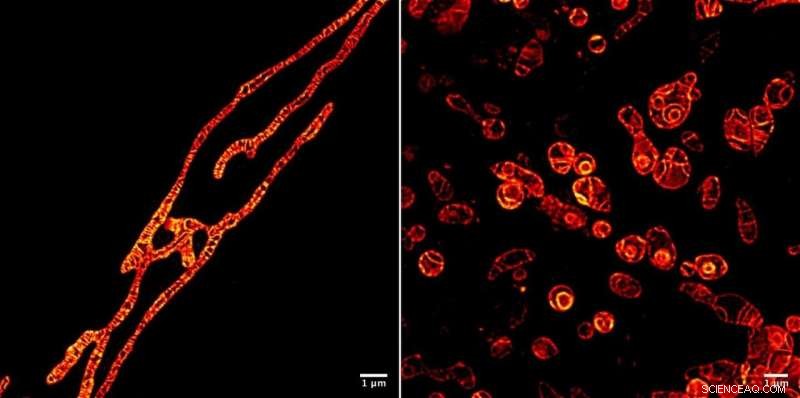
Indre membraner af levende mitokondrier under et STED-mikroskop afbildet ved hjælp af MitoPB Yellow fluorescerende markørmolekyle skabt af forskere ved Institute of Transformative Bio-Molecules (ITbM) ved Nagoya University. De ydre membraner af mitokondrierne er usynlige. Markørmolekylet kan modstå STED-strålen i relativt lang tid, som tillader time-lapse billeddannelse af det levende motiv. Prøveforberedelse er meget lettere for et optisk mikroskop end et transmissionselektronmikroskop (TEM), kræver omkring en time i stedet for en dag. Celler kan ikke afbildes levende ved hjælp af TEM. Mitokondrierne er blevet behandlet med et reagens, der undertrykker DNA-replikation, fremkalde dysfunktion, for at se deres overlevelse (venstre) og døende (højre) processer. At kunne se de dysfunktionsprocesser, der opstår inde i mitokondrier, vil føre til en bedre måde at diagnosticere menneskelig mitokondriesygdom på - og måske endda en kur. Kredit:© ITbM, Nagoya Universitet
Lysmikroskopi er den eneste måde, hvorpå vi kan se ind i en levende celle, eller levende væv, i tre dimensioner. Et elektronmikroskop giver kun et todimensionelt billede, og den organiske prøve ville hurtigt brænde op på grund af den ekstreme varme fra elektronstrålen, og kan derfor ikke observeres i live. I øvrigt, ved at markere biomolekylerne i den struktur, vi er interesserede i, med et specielt designet fluorescerende molekyle, vi kan skelne det fra omgivelserne:dette er fluorescensmikroskopi.
Indtil midten af 1990'erne var fluorescensmikroskopi hæmmet af grundlæggende fysik:på grund af diffraktionsgrænsen, alle træk på prøven tættere sammen end omkring 250 nanometer ville blive sløret sammen. Virus og individuelle proteiner er meget mindre end dette, så de kunne ikke studeres på denne måde. Men omkring 1994 i en vidunderlig lektion, der lærer os, at vi skal passe på, når vi anvender grundlæggende fysiske principper, Stefan Hell opdagede Stimulated Emission Depletion (STED) mikroskopi, som nu er en af flere optiske mikroskopiske tilgange, der opnår "superopløsning, " opløsning ud over diffraktionsgrænsen. Han modtog Nobelprisen i kemi i 2014 "for udviklingen af superopløst fluorescensmikroskopi, " sammen med Eric Betzig og William Moerner.
For at se hvorfor diffraktionsgrænsen er et problem, forestil dig, at interessestrukturen er meget lille, sige, 50 nanometer på tværs, som en virus, og er blevet mærket med et fluorescerende biomolekyle. Forestil dig nu at belyse det med en laserplet, sige, 200 nanometer i diameter. De oplyste markørmolekyler udsender lys spontant, på tilfældige tidspunkter, ved fluorescens, med sandsynligheden for at falde hurtigt med tiden. Fotonerne fra mange fluorescerende molekyler fokuseres på en detektor ved hjælp af linser, skabe en enkelt funktionsløs pixel. Det er ikke helt lyst, fordi kun en lille del af prøven i den oplyste cirkel indeholder fluorescerende molekyler. Hvis du skulle flytte laseren 200 nanometer i en hvilken som helst retning, hvor til, i dette eksempel, ingen fluorescerende molekyler er til stede, signalet vil helt sikkert blive mørkt. Så, denne ret svage pixel fortæller os, at der er noget til stede inde i dette prøveområde på 200 nanometer i diameter. Diffraktionsgrænsen forhindrer os i at danne pixels fra mindre områder, hvis vi bruger den grundlæggende tilgang.
Den fysiske idé med STED-mikroskopi er meget enkel. Med laserpletten oplyser området omkring den lille fluorescerende struktur igen, antag, at du på en eller anden måde stopper lys, der sendes til detektoren fra et så stort område som muligt inden for stedet – og efterlader et meget mindre sted, sige, 60 nanometer i diameter. Hvis du nu flytter laseren 60 nanometer i en hvilken som helst retning, og signalet bliver mørkt, pixlen i billedet repræsenterer tilstedeværelsen af struktur på op til 60 nanometer på tværs. Diffraktionsgrænsen er blevet slået. Selvfølgelig, en sådan pixel er uden funktioner, men et skarpt billede af mitokondrier kan opbygges ved at scanne på tværs og optage mange pixels med varierende lysstyrke. (Se figur 1. "Time-gated STED Microscopy" blev brugt til at fange de fleste af billederne i dette papir.)
Stefan Hells nobelprisvindende opdagelse består af to indsigter. Først, han tænkte på ideen om at stoppe lys, der sendes til detektoren fra så stort et område som muligt inden for et oplyst sted, hvis størrelse matcher diffraktionsgrænsen. Sekund, han fandt ud af, hvordan han rent faktisk opnåede det.
To lasere oplyser det samme sted. Den første laser exciterer markørmolekylets elektroner, og de henfalder spontant tilbage til deres grundtilstand, hver udsender en synlig foton med en bestemt bølgelængde. (Dette er fluorescens.) Processen er tilfældig, med emissionssandsynlighed aftagende med tiden ret hurtigt, hvilket betyder, at de fleste fotoner udsendes inden for de første par nanosekunder af prøven, der belyses. En anden laser, "STED-strålen, "formet med et hul i midten for ikke at påvirke markørmolekylerne der, er indstillet til at stimulere emission af en foton fra det exciterede markørmolekyle i den ydre ring. Men hvordan adskiller disse fotoner sig fra fotoner udsendt fra midten?
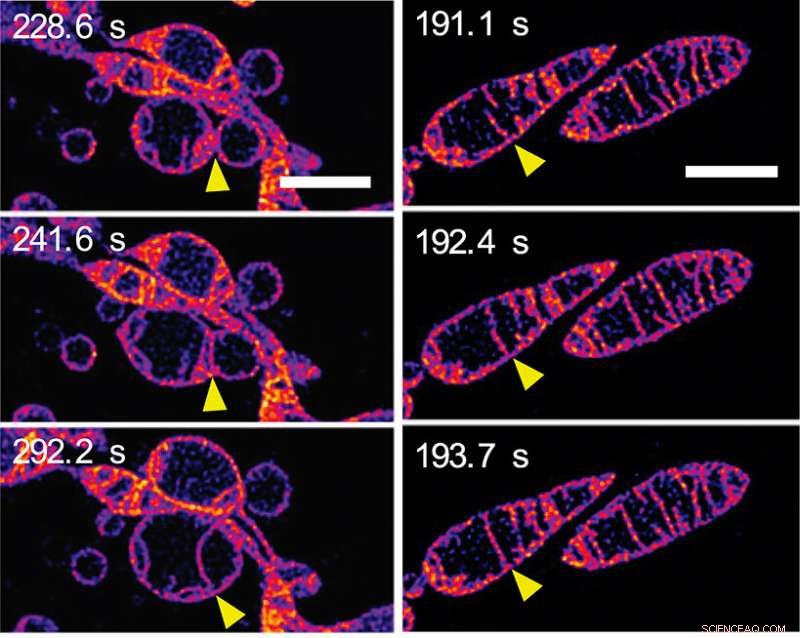
Som reaktion på at blive frataget næringsstoffer, mitokondrier smelter sammen og øger antallet af cristae. (a) Rammer fra en time-lapse-sekvens, der viser to separate mitokondrier, der smelter sammen for at danne en enkelt mitokondrie. De ydre membraner af mitokondrierne er usynlige:vi ser de indre membraner smelte sammen. (b) Rammer fra en time-lapse-sekvens, der viser to cristae inde i en enkelt mitokondrie, der smelter sammen. (Se video 2 i det supplerende materiale på avisens PNAS-webside.) Målestokerne repræsenterer 2 mm. Kredit:© ITbM, Nagoya Universitet
Emissionsprocessen fra den ydre ring er også tilfældig, men sker meget hurtigere, sandsynligheden falder hurtigt, hvilket betyder, at de fleste af disse fotoner udsendes inden for et nanosekund eller deromkring. Mens de to overlejrede stråler scanner hen over prøven, når midten af ringen er fluorescerende, de omgivende molekyler er allerede blevet tvunget ind i deres grundtilstand ved at udsende en foton – de er blevet "slukket". STED-mikroskopiteknikken er afhængig af smart timing på denne måde. I princippet, størrelsen af den glødende centrale plet kan gøres så lille som du ønsker, så enhver løsning er mulig. Imidlertid, den doughnut-formede "STED-stråle" ville så levere energi i form af koncentreret synligt laserlys til et større område af den levende celle, risikerer at dræbe den.
Alligevel, processen er ikke ideel, og det resulterende billede mister en vis skarphed, fordi nogle markørmolekyler i den ydre ring ikke er korrekt slukket - processen er sandsynlig, trods alt - og når de fluorescerer, forurener de signalet fra midten. Imidlertid, på grund af den forskellige timing af den spontane og stimulerede emission, de tidligste fotoner, der ankommer til detektoren, er fra områder belyst af den højeste STED-stråleintensitet, og de sidste fotoner, der ankommer, er højst sandsynligt fra markørmolekyler placeret i det centrale sted. Så ved at vente kort tid (omkring et nanosekund), før du optager billedet, de fleste af fotonerne fra den ydre ring kan filtreres fra. Dette kaldes "Time-gated STED Microscopy." Yderligere skarphed af billedet opnås gennem en proces kaldet deconvolution.
Opfindelsen af superopløsningsmikroskopi varslede et spring fremad inden for biovidenskaberne. Levende organismer kunne observeres med en hidtil uset opløsning. Imidlertid, time-lapse-sekvenser af billeder kunne ikke laves over nogen anstændig tidsperiode, fordi markørmolekylerne ville nedbrydes under den intense STED-stråle og stoppe med at fluorescere. Dette er problemet med fotoblegning. De beskadigede markørmolekyler kan også blive giftige for cellen.
Fotoblegningsproblemet løst
Shigehiro Yamaguchi og Masayasu Taki, fra Nagoya University's Institute for Transformative Bio-Molecules (ITbM), ledet et forskerhold, der har udviklet et markørmolekyle, kaldet "MitoPB Yellow, "der absorberes af mitokondriers indre membran, inklusive cristae - de foldelignende strukturer - og har en lang levetid under en STED-stråle. Ideen til markørmolekylet rettet mod mitokondrier kom fra medforfatter Chenguang Wang, af ITbM. Flerfarvet STED-billeddannelse med en enkelt STED-laser er også muligt; og forskerne forventer, at fluorescerende markører, der ligner MitoPB Yellow, også bør finde en bred vifte af applikationer i andre superopløsningsteknikker (såsom dem, der er udviklet af Eric Betzig og William Moerner).
For at demonstrere den praktiske anvendelighed af MitoPB Yellow til billeddannelse af levende celler, gruppen placerede mitokondrier under forhold, der vides at forårsage visse strukturelle ændringer - men indtil nu er disse kun blevet observeret ved hjælp af transmissionselektronmikroskopi, som ikke kan bruges på levende celler. Mitokondrierne blev behandlet med et reagens, der undertrykker DNA-replikation, fremkalde dysfunktion, for at observere deres overlevelses- og døende processer.
Derefter, ved hjælp af tidsstyret STED-mikroskopi, forskerholdet lavede stillbilleder ved 60 nanometer opløsning (ca. en tusindedel af bredden af et menneskehår), samt time-lapse billedsekvenser, der viser mitokondrierne, der reagerer på en mangel på næringsstoffer ved at ændre form for at overleve. De lange billedsekvenser - på op til 600 billeder - er de første nogensinde lavet af mitokondrier ved den relativt høje rumlige opløsning på 90 nanometer. (Se video 1, som viser en time-lapse-sekvens optaget over næsten 7 minutter.)
I løbet af få minutter ændrede den indre mitokondriestruktur sig dramatisk på en række måder. I første omgang, forlængelse og stigning i antallet af cristae blev set. En billedsekvens (se figur 2a) viser indre membraner af nabomitokondrier, der smelter sammen - med andre ord, to mitokondrier smelter sammen for at lave en. En anden billedsekvens (se figur 2b) viser to cristae inden for en enkelt mitokondrie, der tilsyneladende smelter sammen. Forlængelse og skabelse af flere cristae menes at øge effektiviteten af energiproduktionen (ATP-syntese) og samtidig beskytte mitokondriet mod "autophagosomal nedbrydning" - en programmeret død, hvis formål er at fjerne unødvendige eller dysfunktionelle komponenter fra cellen og tillade den ordnede nedbrydning og genanvendelse af cellulære komponenter.
Efter den indledende forlængelsesperiode, de indre membraner af nogle mitokondrier splittes i kugler, der svulmede og mistede cristae (se film S2); nogle kugler sprængte (Film S4). Nogle dannede koncentriske kugler (figur 1 og video 1). Fluorescensintensiteten forblev den samme. Bemærkelsesværdigt her er, at cristae og membraner forbliver lige så skarpt afbildet som før, hvilket indikerer, at årsagen til mitokondriens død ikke er toksicitet på grund af nedbrydning af markørmolekylet under strålen. Den ekstremt stærke STED-laser kunne have beskadiget mitokondrierne, selvom præcis hvorfor de brister er ukendt.
På disse billeder, efter at have set indledende overlevelsesreaktioner, vi ser mitokondriernes død under den intense STED-stråle. En fremtidig forskningsretning vil være at reducere intensiteten af STED-laserstrålen ved at skabe et fluorescerende markørmolekyle, der lyser, når det belyses af lys med en længere bølgelængde og derfor lavere energi. Mitokondrierne kan så leve længere.
Imidlertid, selv med MitoPB Yellow, dødsprocessen – som ikke er godt forstået – kan studeres. Ingen ved, om de morfologiske (strukturelle) ændringer observeret under dødsprocessen er relateret til apoptose (normal, kontrolleret død) eller nekrose (død som følge af skade eller funktionsfejl). Apoptose er kendt for at blive udløst af et signalmolekyle kaldet cytochrom C:hvis der kan findes et reagens, der undertrykker cytochrom C, så kunne mitokondrier – og menneskelige celler – leve længere.
At være i stand til at se de processer, der foregår inde i mitokondrier, burde føre til en bedre måde at diagnosticere menneskelig mitokondriesygdom på - og måske endda til en kur.
Sidste artikelNy syntesemetode åbner muligheder for organisk elektronik
Næste artikelTo-i-én kontrastmiddel til medicinsk billeddannelse
 Varme artikler
Varme artikler
-
 Produktion af drop-in brændstof fra biomasse ved mikrobiel og elektrokemisk omdannelseForskere har vist, at kombinationen af mikrobiel og elektrokemisk omdannelse af biomasse kan give værdifulde produkter. Kredit:UFZ / André Künzelmannn Forskere ved Helmholtz Center for Miljøfors
Produktion af drop-in brændstof fra biomasse ved mikrobiel og elektrokemisk omdannelseForskere har vist, at kombinationen af mikrobiel og elektrokemisk omdannelse af biomasse kan give værdifulde produkter. Kredit:UFZ / André Künzelmannn Forskere ved Helmholtz Center for Miljøfors -
 Nyt materiale viser sig at afsalte vand mere effektivtKredit:University of Notre Dame Inden 2025, to tredjedele af verdens befolkning kan opleve mangel på ferskvand. For at løse dette problem, forskere fra University of Notre Dame har identificeret e
Nyt materiale viser sig at afsalte vand mere effektivtKredit:University of Notre Dame Inden 2025, to tredjedele af verdens befolkning kan opleve mangel på ferskvand. For at løse dette problem, forskere fra University of Notre Dame har identificeret e -
 Hvordan danner polære molekyler hydrogenbindinger?Polære molekyler, der inkluderer et brintatom, kan danne elektrostatiske bindinger kaldet brintbindinger. Brintatomet er unikt, idet det består af et enkelt elektron omkring en enkelt proton. Når elek
Hvordan danner polære molekyler hydrogenbindinger?Polære molekyler, der inkluderer et brintatom, kan danne elektrostatiske bindinger kaldet brintbindinger. Brintatomet er unikt, idet det består af et enkelt elektron omkring en enkelt proton. Når elek -
 Polymer til at fange ammoniakforurening realiseretAt arbejde i laboratoriet kan være lidt rodet. Dette skud er fra den faktiske produktion af polymeren på kemilaboratoriet. Men ligesom Heloisa Bordallos studerende siger:Ren lab =ingen arbejder! Kredi
Polymer til at fange ammoniakforurening realiseretAt arbejde i laboratoriet kan være lidt rodet. Dette skud er fra den faktiske produktion af polymeren på kemilaboratoriet. Men ligesom Heloisa Bordallos studerende siger:Ren lab =ingen arbejder! Kredi
- Fordelene ved en fast affaldsforbrændingsanlæg
- Forskere undersøger, hvordan det subtile valg af synonymer kan tippe din hånd med hensyn til, hvil…
- Små nanopartikler tilbyder et betydeligt potentiale til at opdage/behandle sygdom ny gennemgang af …
- Forskere udvikler papirbaserede sensorer til kuldioxid
- Er USA afhængig af benzin?
- Røg ved brande kan reducere regndråber til meningsløs støvregn, undersøgelse siger. Her er hvor…


