Hvorfor SF6 -molekyle usædvanligt stabil?
1. Stærke svovlfluorbindinger:
* Høj elektronegativitet af fluor: Fluor er det mest elektronegative element, hvilket betyder, at det stærkt tiltrækker elektroner. Dette skaber en stærk polær kovalent binding mellem svovl og fluor, hvilket gør bindingen meget stabil.
* lille størrelse af fluor: Den lille størrelse af fluor giver mulighed for tæt nærhed mellem svovl- og fluoratomerne, hvilket yderligere styrker bindingen.
* energi med høj binding: S-F-bindingen har en meget høj bindingsenergi, hvilket betyder, at den kræver en betydelig mængde energi at bryde.
2. Octahedral geometri:
* symmetrisk fordeling af elektrondensitet: Octahedral geometri af SF 6 Molekyle sikrer en symmetrisk fordeling af elektrondensitet omkring svovlatomet. Dette symmetriske arrangement minimerer elektronelektronafvisninger, hvilket bidrager til molekylets stabilitet.
* Ingen ensomme par på svovl: Svovlatomet i SF 6 Har ingen ensomme par elektroner. Dette eliminerer ethvert potentiale for elektronelektron-frastødelse, der kan destabilisere molekylet.
3. Inertness:
* Høj ioniseringspotentiale for svovl: Svovl har et højt ioniseringspotentiale, hvilket gør det vanskeligt at fjerne et elektron fra molekylet. Dette gør SF 6 Relativt ureaktiv og mindre tilbøjelig til kemisk angreb.
* fravær af umættede obligationer: SF 6 har ingen dobbelt- eller tredobbelt obligationer, hvilket gør det meget modstandsdygtigt over for tilsætningsreaktioner.
4. Mangel på polariserbarhed:
* Høj elektronegativitet af fluor: Den høje elektronegativitet af fluor gør SF 6 Molekyle meget polær. Denne polariserbarhed forhindrer molekylet i let at interagere med andre molekyler, hvilket yderligere forbedrer dens stabilitet.
5. Kinetisk inerthed:
* Høj aktiveringsenergi til reaktioner: De stærke S-F-bindinger og svovlens høje ioniseringspotentiale skaber en høj aktiveringsenergibarriere for eventuelle reaktioner. Denne kinetiske inertness gør SF 6 Meget langsomt at reagere under normale forhold.
Konsekvenser af stabilitet:
* Høj kemisk modstand: SF 6 er ekstremt modstandsdygtig over for kemisk angreb, hvilket gør det nyttigt i forskellige anvendelser.
* Fremragende elektrisk isolator: Den høje dielektriske styrke og inertitet af SF 6 Gør det til en fremragende elektrisk isolator.
* lang levetid i atmosfæren: Den høje stabilitet af SF 6 bidrager til sin lange levetid i atmosfæren, hvilket gør det til en potent drivhusgas.
Sammenfattende er den ekstraordinære stabilitet af SF 6 tilskrives en kombination af stærke S-F-bindinger, octahedral geometri, høj ioniseringspotentiale af svovl, mangel på polariserbarhed og kinetisk inertitet. Disse faktorer resulterer i et molekyle, der er meget modstandsdygtigt over for kemiske reaktioner, hvilket gør det nyttigt i forskellige industrielle anvendelser, men også en bekymring på grund af dens miljøpåvirkning som drivhusgas.
 Varme artikler
Varme artikler
-
 Forskere designer ny proteinstrukturSpørge proteiner. Kredit:Emily G. Baker et al. Denne forskning vil hjælpe med at designe små proteiner og små molekyler, der kan danne grundlag for fremtidens bioteknologier og medicin. Et team a
Forskere designer ny proteinstrukturSpørge proteiner. Kredit:Emily G. Baker et al. Denne forskning vil hjælpe med at designe små proteiner og små molekyler, der kan danne grundlag for fremtidens bioteknologier og medicin. Et team a -
 Bliver ung, fra cellerne og opKredit:CC0 Public Domain Forskere ved Université de Montréal og McGill University har opdaget et nyt multi-enzymkompleks, der omprogrammerer stofskiftet og overvinder cellulær senescens, når aldr
Bliver ung, fra cellerne og opKredit:CC0 Public Domain Forskere ved Université de Montréal og McGill University har opdaget et nyt multi-enzymkompleks, der omprogrammerer stofskiftet og overvinder cellulær senescens, når aldr -
 Forskere muliggør indenlandske højtydende bipolære membranerKredit:University of Science and Technology of China Den bipolare membran, en type ionbytningsmembran, betragtes som det afgørende materiale for nulemissionsteknologi. Det består af et anode- og k
Forskere muliggør indenlandske højtydende bipolære membranerKredit:University of Science and Technology of China Den bipolare membran, en type ionbytningsmembran, betragtes som det afgørende materiale for nulemissionsteknologi. Det består af et anode- og k -
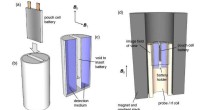 Kemikere udvikler MRI-lignende teknik til at opdage, hvad der fejler batterierEt team af kemikere har udviklet en MRI-baseret teknik, der hurtigt kan diagnosticere, hvad der fejler visse typer batterier - fra at bestemme, hvor meget ladning der er tilbage til at opdage interne
Kemikere udvikler MRI-lignende teknik til at opdage, hvad der fejler batterierEt team af kemikere har udviklet en MRI-baseret teknik, der hurtigt kan diagnosticere, hvad der fejler visse typer batterier - fra at bestemme, hvor meget ladning der er tilbage til at opdage interne
- Angiv antallet af atomer for hvert grundstof i denne forbindelse CaCO3?
- Hvad er statisk potentiel energi?
- En allieret til legeringer:AI hjælper med at designe højtydende stål
- Hvordan bevæger himmelobjekter sig sammenlignet med horisonterne?
- Hvor længe er et let år, hvad beskriver?
- Kostbar frost i Frankrig tilskrives klimaændringer


