Hvor mange atomer er til stede i 0,0350 mol bariumphosphat?
1. Bestem antallet af atomer pr. Formelenhed:
* Bariumphosphat (ba₃ (po₄) ₂) har:
* 3 Barium (BA) atomer
* 2 fosfor (P) atomer
* 8 ilt (O) atomer
* I alt:3 + 2 + 8 =13 atomer pr. Formelenhed
2. Beregn antallet af formelenheder:
* Avogadros nummer fortæller os, at der er 6,022 x 10²³ formelenheder i en mol af ethvert stof.
* Derfor indeholder 0,0350 mol bariumphosphat:
* 0,0350 mol * (6,022 x 10²³ Formel enheder/mol) =2,108 x 10²² Formelenheder
3. Beregn det samlede antal atomer:
* Multiplicer antallet af formelenheder med antallet af atomer pr. Formelenhed:
* (2.108 x 10²² formelenheder) * (13 atomer/formelenhed) = 2,74 x 10²³ atomer
Derfor er der ca. 2,74 x 10²³ atomer til stede i 0,0350 mol bariumphosphat.
 Varme artikler
Varme artikler
-
 Synligt lys og nanopartikelkatalysatorer producerer ønskelige bioaktive molekylerMolekyler adsorberer på overfladen af halvledernanopartikler i meget specifikke geometrier. Nanopartiklerne bruger energi fra indfaldende lys til at aktivere molekylerne og smelte dem sammen til at
Synligt lys og nanopartikelkatalysatorer producerer ønskelige bioaktive molekylerMolekyler adsorberer på overfladen af halvledernanopartikler i meget specifikke geometrier. Nanopartiklerne bruger energi fra indfaldende lys til at aktivere molekylerne og smelte dem sammen til at -
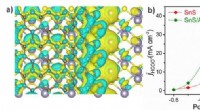 Forskere foreslår en ny strategi for elektrokemisk reduktion af kuldioxidDifferentialladningsdiagrammet for SnS/Aminated-C for (a) og den delvise strømtæthed af formiatproduktion for SnS og SnS/Aminated-C for (b). Kredit:CHEN Zhipeng Kuldioxid (CO 2 ) emission er ble
Forskere foreslår en ny strategi for elektrokemisk reduktion af kuldioxidDifferentialladningsdiagrammet for SnS/Aminated-C for (a) og den delvise strømtæthed af formiatproduktion for SnS og SnS/Aminated-C for (b). Kredit:CHEN Zhipeng Kuldioxid (CO 2 ) emission er ble -
 Kemikere syntetiserer flade siliciumforbindelser3D -repræsentation af et af de nye molekyler. Silikationer i tetraedrisk arrangement kan ses i de sfæriske sæbebobler til sammenligning. Kredit:Jens Rump / University of Bonn Kemikere ved universi
Kemikere syntetiserer flade siliciumforbindelser3D -repræsentation af et af de nye molekyler. Silikationer i tetraedrisk arrangement kan ses i de sfæriske sæbebobler til sammenligning. Kredit:Jens Rump / University of Bonn Kemikere ved universi -
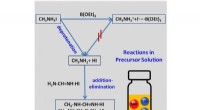 Aldring af perovskite-løsning:Forskere finder en løsningDen rene stabilisator triethylborat bruges til at hæmme sidereaktioner i perovskit-opløsningen. Kredit:WANG Xiao Et forskerhold fra Qingdao Institute of Bioenergy and Bioprocess Technology (QIBEBT
Aldring af perovskite-løsning:Forskere finder en løsningDen rene stabilisator triethylborat bruges til at hæmme sidereaktioner i perovskit-opløsningen. Kredit:WANG Xiao Et forskerhold fra Qingdao Institute of Bioenergy and Bioprocess Technology (QIBEBT
- Strammere FAA -regler om piloter forbundet med højere billetpriser, færre flyvninger
- Den bedste definition af den ydre kantkontinentalsokkel er det punkt hvor?
- Rusland tager hård hånd til internettet for at blokere beskedapp (Opdatering)
- Hvilke kondensatorer er lavet af?
- Hvilke planeter måne navn er ganymede?
- Hvordan tidlige landmænd i Skandinavien overvandt klimaforandringerne


