Hvorfor har aluminium en højere smeltetemperatur end natrium?
* Metallisk binding: Både aluminium og natrium er metaller, og deres atomer holdes sammen ved metallisk binding. Dette involverer et "hav" af delokaliserede elektroner, der deles mellem positivt ladede ioner. Imidlertid varierer styrken af metallisk binding afhængigt af faktorer som:
* Antal valenselektroner: Aluminium har tre valenselektroner, der bidrager mere til elektronhavet end natriums enkelt valenselektron. Dette skaber stærkere attraktioner mellem de positive ioner og elektronhavet.
* atomstørrelse: Aluminiumatomer er mindre end natriumatomer. Dette resulterer i tættere pakning af aluminiumatomer og stærkere elektrostatisk tiltrækning mellem de positivt ladede ioner og de delokaliserede elektroner.
* krystalstruktur: Aluminium har en ansigtscentreret kubisk (FCC) krystalstruktur, som er mere kompakt og stabil end den kropscentrerede kubiske (BCC) struktur af natrium. Denne strammere pakning i FCC -strukturen fører til stærkere bindinger og et højere smeltepunkt.
Kortfattet:
* flere valenselektroner i aluminium: Stærkere metallisk binding.
* mindre atomstørrelse i aluminium: Stærkere elektrostatiske attraktioner mellem de positive ioner og elektronhavet.
* mere stabil krystalstruktur i aluminium: Strammere pakning og stærkere obligationer.
Alle disse faktorer bidrager til, at aluminium har et signifikant højere smeltepunkt (660,3 ° C) sammenlignet med natrium (97,72 ° C).
Sidste artikelKan klor og neon danne en forbindelse?
Næste artikelHvilket metal reagerer det samme var som kalium?
 Varme artikler
Varme artikler
-
 Molekylær magnetisme pakker strøm med messenger -elektronAtomer på tilstødende molekyler som dette kan kobles til en lang, magnetisk kæde, skabe en ny type magnetisk struktur, siger John Berry, professor i kemi ved University of Wisconsin-Madison. Kredit:Da
Molekylær magnetisme pakker strøm med messenger -elektronAtomer på tilstødende molekyler som dette kan kobles til en lang, magnetisk kæde, skabe en ny type magnetisk struktur, siger John Berry, professor i kemi ved University of Wisconsin-Madison. Kredit:Da -
 Ingeniører forvandler plastisolator til varmelederForskere på MIT har designet en ny måde at konstruere en polymerstruktur på molekylært niveau, via kemisk dampaflejring. Dette giver mulighed for stive, bestilte kæder, kontra det rodede, spaghetti-li
Ingeniører forvandler plastisolator til varmelederForskere på MIT har designet en ny måde at konstruere en polymerstruktur på molekylært niveau, via kemisk dampaflejring. Dette giver mulighed for stive, bestilte kæder, kontra det rodede, spaghetti-li -
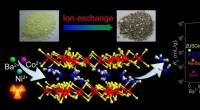 Selektiv indfangning af ioner fra spildevand med lagdelt metalsulfidSelektiv fangst af Ba 2 + , Ni 2 + , og Co 2 + af en robust lagdelt metalsulfid. Kredit:Prof. FENG Det er vigtigt at udvikle kemisk selektive rensemidler for ioner såsom Ba 2 + , N
Selektiv indfangning af ioner fra spildevand med lagdelt metalsulfidSelektiv fangst af Ba 2 + , Ni 2 + , og Co 2 + af en robust lagdelt metalsulfid. Kredit:Prof. FENG Det er vigtigt at udvikle kemisk selektive rensemidler for ioner såsom Ba 2 + , N -
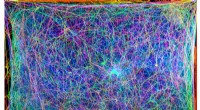 At lave musik fra edderkoppespindTværsnitsbilleder (vist i forskellige farver) af et edderkoppespind blev kombineret til dette 3D-billede og oversat til musik. Kredit:Isabelle Su og Markus Buehler Edderkopper er mesterbyggere, ek
At lave musik fra edderkoppespindTværsnitsbilleder (vist i forskellige farver) af et edderkoppespind blev kombineret til dette 3D-billede og oversat til musik. Kredit:Isabelle Su og Markus Buehler Edderkopper er mesterbyggere, ek


