Hvad er hybridiseringen ved hvert carbonatom i molekyle H8C6?
* valence: Carbon har en valens på 4, hvilket betyder, at den kan danne fire bindinger. Hydrogen har en valens på 1, hvilket betyder, at det kan danne en binding.
* binding: For at danne et stabilt molekyle skal hvert atom fuldføre sin ydre skal af elektroner.
Lad os analysere formlen:
* H8: Dette antyder 8 hydrogenatomer.
* C6: Dette antyder 6 carbonatomer.
For at tilfredsstille valenserne har vi brug for mindst 12 hydrogenatomer (6 carbons X 4 -bindinger hver =24 obligationer, der er nødvendige, og 6 kulhydrater x 1 binding hver =6 obligationer, der allerede er lavet, hvilket efterlader 18 flere bindinger, der skal udfyldes med brint).
mulige strukturer
Der er nogle få mulige strukturer med formlen C6H12:
* hexan: En lige kæde alkan med formlen CH3 (CH2) 4CH3. Alle kulstof er SP3 hybridiserede.
* cyclohexan: En seks-ledet ring med formlen (CH2) 6. Alle kulstof er SP3 hybridiserede.
* isomerer af hexan: Der er forgrenede isomerer af hexan, som 2-methylpentan og 2,3-dimethylbutan. Kulhydraterne med forskellige antal fastgjort atomer vil have forskellige hybridiseringer.
Hybridisering:
* SP3 -hybridisering: Dette forekommer, når et carbonatom danner fire enkeltbindinger. Carbonatomet har fire SP3 -hybrid -orbitaler, hvilket giver det mulighed for at danne tetrahedrale bindinger.
* SP2 -hybridisering: Dette forekommer, når et carbonatom danner en dobbeltbinding. Carbonatomet har tre SP2 -hybrid -orbitaler, hvilket gør det muligt for det at danne trigonale plane bindinger.
* SP -hybridisering: Dette forekommer, når et carbonatom danner en tredobbelt binding. Carbonatomet har to SP -hybrid -orbitaler, så det kan danne lineære bindinger.
For at bestemme hybridiseringen af hvert kulstof i et specifikt C6H12 -molekyle skal du kende molekylets struktur.
 Varme artikler
Varme artikler
-
 MOF-baseret sensor til test af vandkvalitetBegreber brugt i tech-demo-designet:Identifikation af vandkvalitetsproblemet i den lokale befolkning, ændring af bomuld for at udsende lys, der angiver fluoridindholdet, tech-demo design og konstrukti
MOF-baseret sensor til test af vandkvalitetBegreber brugt i tech-demo-designet:Identifikation af vandkvalitetsproblemet i den lokale befolkning, ændring af bomuld for at udsende lys, der angiver fluoridindholdet, tech-demo design og konstrukti -
 Liquid nanofoam:En game changer til fremtidige fodboldhjelmeEt elektronisk mikroskopisk billede af nanofoam -materialet. Hver pore er 10 nm i diameter. Kredit:Weiyi Lu En flydende nanofoamforing, der gennemgår test, kan forlænge sikker brug af fodboldhjelm
Liquid nanofoam:En game changer til fremtidige fodboldhjelmeEt elektronisk mikroskopisk billede af nanofoam -materialet. Hver pore er 10 nm i diameter. Kredit:Weiyi Lu En flydende nanofoamforing, der gennemgår test, kan forlænge sikker brug af fodboldhjelm -
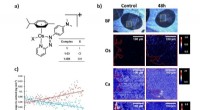 Røntgenfluorescenskortlægning for at måle tumorpenetration af et nyt anticancermiddelFigur 1:A) Struktur af FY26 og relaterede komplekser, [(ŋ6-p-cym)Os(Azpy-NMe2)X]+. B) Lysfeltbilleder og SXRF elementære kort over Os, Ca og Zn i A2780 humane ovariecarcinom sfæroide sektioner (500 nm
Røntgenfluorescenskortlægning for at måle tumorpenetration af et nyt anticancermiddelFigur 1:A) Struktur af FY26 og relaterede komplekser, [(ŋ6-p-cym)Os(Azpy-NMe2)X]+. B) Lysfeltbilleder og SXRF elementære kort over Os, Ca og Zn i A2780 humane ovariecarcinom sfæroide sektioner (500 nm -
 Aflytning af enkelte molekyler med lys ved at afspille snakken igenKredit:CC0 Public Domain Forskere har været banebrydende for en ny teknik til at afsløre skjulte biokemiske veje, der involverer enkelte molekyler på nanoskala. Et team af forskere fra University
Aflytning af enkelte molekyler med lys ved at afspille snakken igenKredit:CC0 Public Domain Forskere har været banebrydende for en ny teknik til at afsløre skjulte biokemiske veje, der involverer enkelte molekyler på nanoskala. Et team af forskere fra University
- Halvtørre land i Kina har udvidet sig i de seneste årtier og vil sandsynligvis fortsætte med at u…
- Hvad sker der med partikler inde i en fast væske eller gas, når energi tilsættes sammenlignet fje…
- Hvad studerer grenen af meteorologi?
- Kemisk forbindelse af iridium III Chlorid hexahydrat?
- Hvad bestemmer amplituden af en lydbølge?
- Hvilken organelle syntetiseres proteiner med?


