Hvordan øges og formindskes temperaturen?
stigende temperatur:
* Varmeoverførsel:
* ledning: Direkte kontakt med et varmere objekt. For eksempel, hvis du placerer en beholder med gas på en varmplade, overføres varmen fra pladen til gasmolekylerne, hvilket får dem til at bevæge sig hurtigere og øge temperaturen.
* konvektion: Varmeoverførsel gennem bevægelse af væsker (væsker eller gasser). Forestil dig en varmluftsballon; Luften inde er opvarmet, bliver mindre tæt og stiger.
* Stråling: Varmeoverførsel gennem elektromagnetiske bølger. Solens stråler opvarmer jordens atmosfære og overfører energi til gasmolekylerne.
* Komprimering: Når du klemmer en gas (mindsker dens volumen), kolliderer molekylerne hyppigere, forøger deres kinetiske energi og dermed hæver temperaturen. Tænk på en cykelpumpe - luften indeni bliver varm, når du pumper den.
* Kemiske reaktioner: Nogle kemiske reaktioner frigiver varme (eksotermiske reaktioner), som kan hæve temperaturen på den omgivende gas. Brændende brændstof er et almindeligt eksempel.
Faldende temperatur:
* varmeoverførsel (omvendt ovenfor):
* ledning: Kontakt med et køligere objekt. Læg en beholder med gas i et isbad, og varme overføres fra gassen til isen, hvilket får den til at afkøle.
* konvektion: Kølig luft kan bevæge sig over en varmere gas og udføre varme. Sådan hjælper en fan med at køle dig ned.
* Stråling: En gas kan miste varmen ved at udstråle energi i køligere omgivelser.
* udvidelse: Når du tillader en gas at udvide, spredes dens molekyler ud og kolliderer mindre ofte. Dette reducerer deres kinetiske energi, hvilket fører til et fald i temperaturen. Tænk på en aerosol kan - når du sprøjter den, udvides gassen og afkøles.
* faseændring: Hvis du afkøler en gas nok, kan den skifte til en væske (kondens) eller en solid (frysning). Begge disse overgange frigiver varme, hvilket yderligere sænker gassens temperatur.
Nøglepunkter:
* kinetisk energi: Temperaturen er direkte relateret til den gennemsnitlige kinetiske energi for gasmolekylerne. Højere kinetisk energi betyder højere temperatur.
* intern energi: Den samlede kinetiske og potentielle energi af molekylerne i en gas er dens indre energi.
* tryk: I en lukket beholder øger øget temperaturen på en gas også sit tryk. Dette skyldes, at molekylerne kolliderer med containerens vægge oftere og med større kraft.
Fortæl mig, hvis du har flere spørgsmål!
Sidste artikelVar Rutherfords model af Atomet forkert eller ufuldstændig forklar svar?
Næste artikelHvad er det at lede materialer?
 Varme artikler
Varme artikler
-
 blidere, sikrere hårfarve baseret på syntetisk melaninEn mildere hårfarve baseret på syntetisk melanin kan producere en række farver, fra mørkebrun til rødguld. Kredit:Tilpasset fra ACS Central Science 2020, DOI:10.1021/acscentsci.0c00068 Med coron
blidere, sikrere hårfarve baseret på syntetisk melaninEn mildere hårfarve baseret på syntetisk melanin kan producere en række farver, fra mørkebrun til rødguld. Kredit:Tilpasset fra ACS Central Science 2020, DOI:10.1021/acscentsci.0c00068 Med coron -
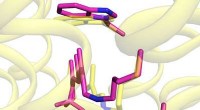 Lys-inducerede ændringer i form driver en pumpe i en marin bakterieFigur 1:Lysinducerede ændringer i strukturen (lyserøde stænger) nær en chloridion (blå kugle) er overlejret på hviletilstandsstrukturen af et pumpende protein (gult). Vandmolekyler er afbildet af rø
Lys-inducerede ændringer i form driver en pumpe i en marin bakterieFigur 1:Lysinducerede ændringer i strukturen (lyserøde stænger) nær en chloridion (blå kugle) er overlejret på hviletilstandsstrukturen af et pumpende protein (gult). Vandmolekyler er afbildet af rø -
 Et usandsynligt ægteskab blandt oxiderClaudia Cancellieri og Sebastian Siol undersøger heterostrukturelle legeringer på Empas Laboratory for Joining Technologies and Corrosion. Kredit:Swiss Federal Laboratories for Materials Science and T
Et usandsynligt ægteskab blandt oxiderClaudia Cancellieri og Sebastian Siol undersøger heterostrukturelle legeringer på Empas Laboratory for Joining Technologies and Corrosion. Kredit:Swiss Federal Laboratories for Materials Science and T -
 Genbrugsbomuld bliver til nyt stofKredit:Pixabay/CC0 Public Domain Mange af os genbruger vores gamle tekstiler, men de færreste af os ved, at de er meget svære at genbruge, og ender alligevel ofte på lossepladser. Nu, forskere ved
Genbrugsbomuld bliver til nyt stofKredit:Pixabay/CC0 Public Domain Mange af os genbruger vores gamle tekstiler, men de færreste af os ved, at de er meget svære at genbruge, og ender alligevel ofte på lossepladser. Nu, forskere ved
- Hvad er de 5 grene af fysik og deres betydning?
- Hvad hedder strålingsbælter omkring Jorden, der blev opdaget i 1958?
- Hvilket var det første objekt, der landede på Moon?
- Hvad er afstanden fra Jorden?
- Kører ækvator gennem Atlanterhavet?
- Axing Lightning til iPhone ville betyde hidtil uset e-affald, siger Apple


