Var Rutherfords model af Atomet forkert eller ufuldstændig forklar svar?
* styrker af Rutherfords model: Rutherfords model, baseret på hans berømte guldfolieeksperiment, var et revolutionerende gennembrud. Det forklarede med succes:
* eksistensen af en tæt, positivt ladet kerne: Dette var den vigtigste indsigt, der viste, at atomet ikke var en ensartet sfære med positiv ladning, som Thomsons model antydede.
* Atomet er for det meste tomt rum: Langt de fleste alfapartikler passerede lige gennem guldfolien, hvilket indikerer, at atomer for det meste er tomme rum med en lille, tæt kerne.
* svagheder i Rutherfords model: Imidlertid havde Rutherfords model begrænsninger:
* Ingen forklaring på spektrale linjer: Det kunne ikke forklare, hvorfor atomer udsender specifikke bølgelængder af lys (spektrale linjer), når de opvarmes.
* Elektroner, der kredser om kernen, skal miste energi: I henhold til klassisk fysik skal elektroner, der kredser om en kerne, konstant miste energi og spiral ind i kernen, hvilket får atomet til at kollapse. Dette skete ikke.
Bohr -modellen: Niels Bohr bygget senere på Rutherfords model ved at inkorporere kvanteteori. Bohrs model behandlede begrænsningerne i Rutherfords model ved at foreslå:
* Kvantiserede energiniveau: Elektroner optager specifikke energiniveauer, og de kan kun hoppe mellem disse niveauer ved at absorbere eller udsende specifikke mængder energi. Dette forklarede de spektrale linjer, der blev observeret i atomer.
* Stabile elektronkrav: Elektroner spiral ikke ind i kernen, fordi de er i stabile kredsløb ved specifikke energiniveauer.
Konklusion: Rutherfords model var et vigtigt skridt i forståelsen af atomet, men det var ufuldstændigt. Bohrs model, der inkorporerede kvanteteori, gav et mere komplet billede af atomstruktur.
Sidste artikelHvad er de negative og positive dele af et atom?
Næste artikelHvordan øges og formindskes temperaturen?
 Varme artikler
Varme artikler
-
 Video:Hvad er kemien bag ringorm?Vidste du, at ringorm faktisk ikke er en orm? Denne uge om reaktioner, find ud af hvad ringorm er; hvordan den skyldige lever af din hud, hår og negle; og hvordan man ikke bliver det næste måltid:
Video:Hvad er kemien bag ringorm?Vidste du, at ringorm faktisk ikke er en orm? Denne uge om reaktioner, find ud af hvad ringorm er; hvordan den skyldige lever af din hud, hår og negle; og hvordan man ikke bliver det næste måltid: -
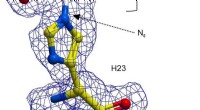 Kemikere viser, at det katalytiske udvalg af enzymer kan udvidesEn kugle-og-stik-repræsentation af H23 fra BH32 hæmmet med 2-bromacetophenon, farvet efter atomtype med H23 carbonatomer i gul og acetophenon carboner i hvid. Klar FEM elektrondensitet (blå, konturere
Kemikere viser, at det katalytiske udvalg af enzymer kan udvidesEn kugle-og-stik-repræsentation af H23 fra BH32 hæmmet med 2-bromacetophenon, farvet efter atomtype med H23 carbonatomer i gul og acetophenon carboner i hvid. Klar FEM elektrondensitet (blå, konturere -
 Nyt værktøj kunne behandle blodinfektioner hurtigtKredit:CC0 Public Domain Blodbaneinfektioner er notorisk dødelige. Ikke fordi de ikke kan behandles, men fordi de arbejder hurtigt og er svære at diagnosticere. For at finde ud af, hvilken medicin
Nyt værktøj kunne behandle blodinfektioner hurtigtKredit:CC0 Public Domain Blodbaneinfektioner er notorisk dødelige. Ikke fordi de ikke kan behandles, men fordi de arbejder hurtigt og er svære at diagnosticere. For at finde ud af, hvilken medicin -
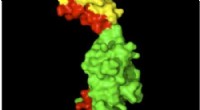 Nyt forskningsområde:Hvordan proteinstrukturer ændrer sig på grund af normale kræfterStrukturen af myomesin med elastiske områder vist med rødt. Kredit:Matthias Wilmanns Proteiner fremstillet i vores celler foldes i bestemte former, så de kan opfylde deres funktioner. Forskere h
Nyt forskningsområde:Hvordan proteinstrukturer ændrer sig på grund af normale kræfterStrukturen af myomesin med elastiske områder vist med rødt. Kredit:Matthias Wilmanns Proteiner fremstillet i vores celler foldes i bestemte former, så de kan opfylde deres funktioner. Forskere h
- Er der gletsjere på Fiji Island -bjerge?
- Det kan betale sig at være hovedfag inden for områder med tætte bånd til job, viser undersøgels…
- Hvad betyder det, når du siger, at vand er en polære molekyler?
- Flydende metal kan være en Terminator-terror i den globale kamp mod patogener
- Trans-Pacific rejse af atmosfæriske partikler
- Kometer kollapser klipper og hoppende kampesten


