Når et stof er neutralt?
Her er nogle nøglepunkter om neutralitet:
* atomer: Individuelt er atomer normalt neutrale. Dette skyldes, at de har et lige antal protoner (positivt ladede) og elektroner (negativt ladet).
* molekyler: Molekyler dannes, når atomer binder sig sammen. De kan være neutrale, hvis det samlede antal protoner og elektroner i molekylet er ens.
* Løsninger: Opløsninger kan være neutrale, sure eller basiske (alkaliske). En neutral opløsning har en pH på 7, hvilket indikerer, at koncentrationen af hydrogenioner (H+) er lig med koncentrationen af hydroxidioner (OH-).
* ph -skala: PH -skalaen måler surhedsgraden eller alkaliniteten af en opløsning. En pH -værdi på 7 er neutral, værdier under 7 er sure, og værdier over 7 er basale.
Eksempler på neutrale stoffer:
* rent vand (H2O) :Har en pH på 7 og betragtes som neutral.
* tabel salt (NaCl) :Natriumchlorid er en neutral forbindelse.
* sukker (C12H22O11) :Et neutralt molekyle.
* nitrogengas (N2) :Et neutralt molekyle.
Det er vigtigt at bemærke, at neutralitet er et relativt koncept . Mens et stof generelt kan være neutralt, kan det stadig have regioner med positiv eller negativ ladning inden for dets struktur.
 Varme artikler
Varme artikler
-
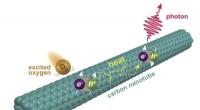 Kemikere får et kig på ny fluorescens i kulstofnanorørKemikere ved Rice University har opdaget et andet niveau af fluorescens i enkeltvæggede kulstofnanorør. Fluorescensen udløses, når oxygenmolekyler exciteret til en singlettilstand interagerer med nano
Kemikere får et kig på ny fluorescens i kulstofnanorørKemikere ved Rice University har opdaget et andet niveau af fluorescens i enkeltvæggede kulstofnanorør. Fluorescensen udløses, når oxygenmolekyler exciteret til en singlettilstand interagerer med nano -
 Hvordan metaller arbejder sammen for at svække hårdføre nitrogen-nitrogen-bindingerKredit:CC0 Public Domain nitrogen, et element, der er essentielt for alle levende celler, udgør omkring 78 procent af Jordens atmosfære. Imidlertid, de fleste organismer kan ikke gøre brug af dett
Hvordan metaller arbejder sammen for at svække hårdføre nitrogen-nitrogen-bindingerKredit:CC0 Public Domain nitrogen, et element, der er essentielt for alle levende celler, udgør omkring 78 procent af Jordens atmosfære. Imidlertid, de fleste organismer kan ikke gøre brug af dett -
 Forskere skubber mikroskopi til sub-molekylær opløsningAt være i stand til at se den indre funktion af de grundlæggende enheder i alt stof er virkelig fantastisk, og det er et af hovedmålene, vi har forfulgt hos CaSTL i mere end et årti, ” siger studie me
Forskere skubber mikroskopi til sub-molekylær opløsningAt være i stand til at se den indre funktion af de grundlæggende enheder i alt stof er virkelig fantastisk, og det er et af hovedmålene, vi har forfulgt hos CaSTL i mere end et årti, ” siger studie me -
 Nye materialer til bæredygtige, lavpris batterierForskerne producerede aluminium knapceller i laboratoriet. Batterikassen er lavet af rustfrit stål belagt med titaniumnitrid på indersiden for at gøre den korrosionsbestandig. Kredit:ETH Zürich / Kost
Nye materialer til bæredygtige, lavpris batterierForskerne producerede aluminium knapceller i laboratoriet. Batterikassen er lavet af rustfrit stål belagt med titaniumnitrid på indersiden for at gøre den korrosionsbestandig. Kredit:ETH Zürich / Kost


