Hvorfor væske skifter til gas i rummet?
1. Lavt tryk:
* Rumvakuumet har ekstremt lavt tryk, næsten nul. Dette betyder, at der er meget få gasmolekyler, der omgiver en væske.
* Uden trykket fra omgivende gasmolekyler har væskemolekylerne mindre modstand mod at flygte ind i vakuumet.
2. Lav temperatur:
* Rummet er utroligt koldt, med temperaturer, der ofte når næsten absolut nul.
* Selvom dette kan virke modstridende, fremmer lave temperaturer faktisk * fordampning.
* Tænk på en vandpyt, der tørrer hurtigere op på en kold, blæsende dag:vinden bærer væk fordampede vandmolekyler hurtigere end stadig luft, hvilket tilskynder til mere fordampning.
* I rummet fungerer det kolde vakuum som en "vind" for flydende molekyler og trækker dem væk.
3. Solstråling:
* Selvom pladsen er kold, kan direkte sollys opvarme genstande markant, inklusive væsker.
* Denne opvarmning øger energien fra væskemolekylerne, hvilket gør det lettere for dem at undslippe væskens overflade og blive gas.
4. Mangel på tyngdekraft:
* Mens tyngdekraften spiller en mindre rolle i processen, handler det mere om dets fravær.
* På jorden fordamper tyngdekraften molekyler tæt på den flydende overflade. I rummet, uden tyngdekraft, kan gasmolekylerne let sprede sig væk fra den originale væske.
Kortfattet:
Kombinationen af lavt tryk, lav temperatur, solstråling og manglen på tyngdekraft skaber et miljø, hvor molekylerne i en væske let får nok energi til at flygte ud i rumvakuumet og omdanne væsken til gas. Denne proces er kendt som sublimering , hvor et stof går direkte fra den faste eller flydende fase til gasfasen.
Sidste artikelHvilken form tager gas?
Næste artikelEr en tegning af en atom videnskabelig definition?
 Varme artikler
Varme artikler
-
 Stort skridt fremad i produktionen af grøn brintKredit:CC0 Public Domain Den første termodynamisk reversible kemiske reaktor, der er i stand til at producere brint som en ren produktstrøm, repræsenterer et transformationelt skridt fremad i den
Stort skridt fremad i produktionen af grøn brintKredit:CC0 Public Domain Den første termodynamisk reversible kemiske reaktor, der er i stand til at producere brint som en ren produktstrøm, repræsenterer et transformationelt skridt fremad i den -
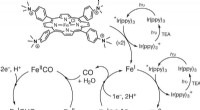 Omdannelse af kuldioxid til metan ved hjælp af jern og sollysSkitse af den foreslåede mekanisme til CO2 -reduktion til CH4 ved katalysator 1. Kredit: Natur (2017). DOI:10.1038/nature23016 (Phys.org) - Et kombineret team af forskere fra Université Paris Did
Omdannelse af kuldioxid til metan ved hjælp af jern og sollysSkitse af den foreslåede mekanisme til CO2 -reduktion til CH4 ved katalysator 1. Kredit: Natur (2017). DOI:10.1038/nature23016 (Phys.org) - Et kombineret team af forskere fra Université Paris Did -
 Maskinlæringsmetoder giver ny indsigt i organisk-uorganiske grænsefladerVed at kombinere to nye maskinlæringsmetoder, TU Graz fysiker Oliver Hofmann var i stand til at tilbagevise teorier om lang rækkevidde ladningsoverførsel mellem organiske og uorganiske materialer. Kre
Maskinlæringsmetoder giver ny indsigt i organisk-uorganiske grænsefladerVed at kombinere to nye maskinlæringsmetoder, TU Graz fysiker Oliver Hofmann var i stand til at tilbagevise teorier om lang rækkevidde ladningsoverførsel mellem organiske og uorganiske materialer. Kre -
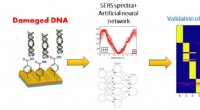 Forskere får neurale netværk til at opdage DNA-skader forårsaget af UV-strålingSkematisk diagram af SERS-sensorens drift i kombination med det neurale netværk til analyse af DNA-skader. Kredit:TPU Forskere ved Tomsk Polytekniske Universitet udførte sammen med Universitetet f
Forskere får neurale netværk til at opdage DNA-skader forårsaget af UV-strålingSkematisk diagram af SERS-sensorens drift i kombination med det neurale netværk til analyse af DNA-skader. Kredit:TPU Forskere ved Tomsk Polytekniske Universitet udførte sammen med Universitetet f
- Hvilke sodavand indeholder citronsyre?
- Antibiotika kan reducere immuncellernes evne til at dræbe bakterier
- Endnu en mild algeopblomstringsprognose for Lake Erie denne sommer
- Hvad er bølgelængden på 250Hz?
- Hvad er den kinetiske energi på en 62,0 g tennisbold, der serveres på tværs af retten på 150 km …
- Opdagede William Gosse Ayers Rock, mens han var på en udforskningsekspedition?


