Hvordan er elektroner i atom organiseret?
1. Energiniveau:
* Elektroner findes i forskellige energiniveauer, også kendt som elektronskaller. Disse skaller er udpeget af tal (1, 2, 3 osv.) Med et højere antal, der indikerer højere energiniveau.
* Elektroner i det samme energiniveau har lignende energi, men de kan yderligere opdeles i underskaller.
2. Underskaller:
* Inden for hvert energiniveau er der underskaller, der er betegnet med bogstaver (S, P, D, F).
* Hver underskal kan indeholde et specifikt antal elektroner:
* s underskal:holder op til 2 elektroner
* P Undershell:Holder op til 6 elektroner
* D Subshell:Holder op til 10 elektroner
* f Undershell:Holder op til 14 elektroner
3. Orbitals:
* Hver underskal består af orbitaler, der repræsenterer regioner i rummet, hvor der er stor sandsynlighed for at finde et elektron.
* Formen og antallet af orbitaler afhænger af underskalet:
* s underskal:1 sfærisk orbital
* P Subshell:3 håndvægteformede orbitaler
* D Subshell:5 komplekse formede orbitaler
* f Undershell:7 Endnu mere komplekse formede orbitaler
4. Aufbau -princippet og Hunds regel:
* aufbau -princip: Elektroner udfylder først de laveste energiniveau.
* Hunds regel: Inden for et underskal fylder elektroner orbitaler individuelt, før de parrer sig sammen i den samme orbital. Dette sikrer maksimal spin -mangfoldighed, hvilket gør atomet mere stabilt.
5. Elektronkonfiguration:
* Elektronkonfigurationen af et atom beskriver fordelingen af elektroner mellem de forskellige energiniveauer, underskaller og orbitaler.
* For eksempel er elektronkonfigurationen af kulstof 1S² 2S²2p². Dette betyder, at carbon har to elektroner i det første energiniveau (1s), to i det andet energiniveau (2S) og to i det andet energiniveau's P -underskal (2P).
Kortfattet:
Elektroner i et atom er organiseret i en hierarkisk struktur af energiniveauer, underskaller og orbitaler. Disse regler og principper bestemmer de unikke egenskaber for hvert element, og hvordan de interagerer med andre atomer.
 Varme artikler
Varme artikler
-
 Enkeltcelleanalyse afslører heterogenitet i metaladsorptionKredit:LuckyStep/Shutterstock Biosorption er fjernelse af kontaminanter fra en prøve ved at adsorbere dem på overfladen af et biologisk materiale. Det forventes at give miljømæssige og økonomiske
Enkeltcelleanalyse afslører heterogenitet i metaladsorptionKredit:LuckyStep/Shutterstock Biosorption er fjernelse af kontaminanter fra en prøve ved at adsorbere dem på overfladen af et biologisk materiale. Det forventes at give miljømæssige og økonomiske -
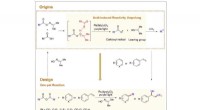 Effektiv metode til fotokatalytiske fluoralkyleringer af (hetero)arenerGrafisk abstrakt. Kredit:Chem Catalysis (2022). DOI:10.1016/j.checat.2022.05.018 Fluoroalkylerede aromatiske forbindelser har egenskaber som permeabilitet, lipofilicitet og metabolisk stabilitet. B
Effektiv metode til fotokatalytiske fluoralkyleringer af (hetero)arenerGrafisk abstrakt. Kredit:Chem Catalysis (2022). DOI:10.1016/j.checat.2022.05.018 Fluoroalkylerede aromatiske forbindelser har egenskaber som permeabilitet, lipofilicitet og metabolisk stabilitet. B -
 Forskere identificerer den indre funktion af cellulære calciumpumperKredit:Aarhus Universitet Förster resonance energy transfer (FRET) kombinerer laserlys og ultrafølsomme kameraer, der sender signaler ind i et individuelt molekyle. Dette signal spredes til det andet
Forskere identificerer den indre funktion af cellulære calciumpumperKredit:Aarhus Universitet Förster resonance energy transfer (FRET) kombinerer laserlys og ultrafølsomme kameraer, der sender signaler ind i et individuelt molekyle. Dette signal spredes til det andet -
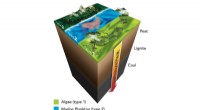 Forskere bruger røntgenstråler til at knække skiferens hemmeligheder, en hjørnesten i en af na…Som vist i denne illustration, som kulstof som det der findes i alger, marine plankton og kystnære landplanter bevæger sig tættere på Jordens kerne, det udsættes for højere temperaturer og tryk, der æ
Forskere bruger røntgenstråler til at knække skiferens hemmeligheder, en hjørnesten i en af na…Som vist i denne illustration, som kulstof som det der findes i alger, marine plankton og kystnære landplanter bevæger sig tættere på Jordens kerne, det udsættes for højere temperaturer og tryk, der æ
- Hvilken af følgende typer elektromagnetisk stråling får visse stoffer til at melsce?
- Hvordan erhverver man stenprøver af havbunden?
- Sådan beregnes tid med 100 minutters ur
- Visualisering af debris disk roller derby for at forstå planetarisk systemudvikling
- Delhi bekæmper farlig forurening efter Diwali -fest
- Hvilke slags sten bruges til at lave statuer?


