Forskere identificerer den indre funktion af cellulære calciumpumper

Kredit:Aarhus Universitet Förster resonance energy transfer (FRET) kombinerer laserlys og ultrafølsomme kameraer, der sender signaler ind i et individuelt molekyle. Dette signal spredes til det andet farvemolekyle på pumpen, som begynder at transmittere lys af en anden farve. Gruppen fokuserer på forholdet mellem de forskellige farver, som er registreret i et specialbygget lysmikroskop. Disse målinger giver information om pumpens bevægelser. Kredit:Mateusz Dyla
For første gang, forskere har observeret ionpumperne, der aktiverer celletransport og signalsystemer. Dette sikrer funktionen af biomolekylære mekanismer.
Hver calciumpumpe måler kun nogle få nanometer i hver retning, og opholder sig i cellemembranerne. Men på trods af dens lille størrelse, det er afgørende for livet. Denne pumpe er grunden til, at vores muskler kan trække sig sammen, og at neuroner kan sende signaler. Hvis den lille pumpe holdt op med at fungere, celler ville stoppe med at kommunikere. Det er derfor, celler bruger så meget af deres energi – omkring en fjerdedel af kroppens brændstof, kendt som ATP – for at holde pumperne kørende.
Der er mange ting, som vi stadig ikke ved om strukturen og funktionen af denne vitale pumpe. Viden om pumpen er afgørende for at forstå energibalancen og andre vigtige funktioner i kroppen.
En dansk forskergruppe har netop offentliggjort et nyt studie, der for første gang viser, hvordan pumpen fungerer på niveau med et enkelt molekyle, og hvordan det sikrer, at ioner pumpes i den rigtige retning. Med andre ord, hvordan pumpen fungerer som en molekylær envejsgade. Opdagelsen er netop blevet offentliggjort i det prestigefyldte tidsskrift Natur .
"Dette arbejde repræsenterer det næste skridt i en dyb og vigtig søgen efter at forstå pumpens atomare struktur og funktion. Vi er nu et skridt tættere på at forstå, hvordan ionpumperne sikrer cellernes funktioner. Vi har karakteriseret, hvordan den pumper ioner ud af cellen på et hidtil uset detaljeringsniveau. Betydningen af en sådan grundlæggende viden om biofysiske processer kan kun undervurderes. Det vil have stor indflydelse på vores forståelse af livets processer og, i tide, om sygdomsbehandling, " siger professor Poul Nissen. Professor Nissen er en af verdens førende eksperter på denne familie af pumper og medforfatter til papiret.
Den molekylære bagstopper
Til en vis grad, historien begyndte i 1950'erne, da professor Jens Christian Skou gjorde sit pionerarbejde på Aarhus Universitet, som afslørede pumpefunktionerne i vores celler. Calciumpumpen er en nær fætter til natrium-kalium pumpen Skou arbejdede på, og de bruger en lignende pumpemekanisme. Skous arbejde gav ham en Nobelpris i kemi i 1997. Siden da, talrige forskere har studeret mekanismen og funktionen af disse pumper, heriblandt mange på Center for Membranpumper i celler og sygdom – PUMPkin – på Aarhus Universitet.
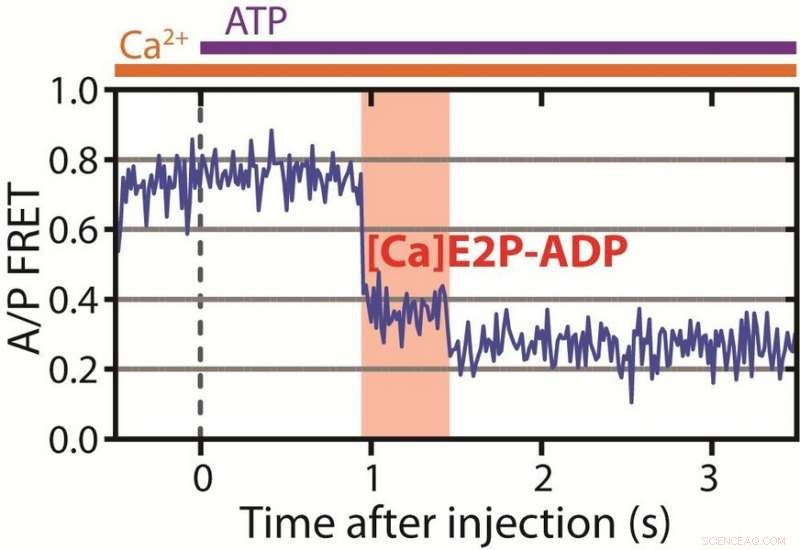
Illustreret her er tidslinjen for pumpefunktionen, som nu afsløres i høj tidsopløsning. Kurven viser forholdet mellem de målte fluorescerende farver udsendt fra farvestoffer bundet til pumpen. Til venstre, pumpen er åben mod cellens indre og har bundet calciumioner og absorberet ATP-molekylet – med andre ord, den er 'opladet'. Næste skridt er det nye, nøgleresultat:i det røde felt, pumpen er i den hidtil ukendte lukkede tilstand, hvor den har indesluttet ionerne, der skal sendes ud af cellen. Det sidste illustrerede trin viser, at pumpen har åbnet sig og frigivet calciumioner til omgivelserne. Herfra, den kan ikke vende tilbage til den fremhævede tilstand. Kredit:Daniel Terry/Dyla
En central indsigt i den nye publikation vedrører iontransportens envejs karakter. Tidligere har det blev antaget, at pumpens envejsnatur opstod i spaltningen af det energirige molekyle ATP. Hypotesen var, at når ATP blev spaltet, pumpen kunne ikke gå tilbage og reformere ATP. Det viste sig at være forkert.
"Vi har identificeret en ny lukket tilstand i pumpecyklussen, som pumpen kun kan komme ind i, hvis calciumionen kommer fra de intracellulære væsker og pumpen har spaltet ATP. Den kan ikke nå denne tilstand, hvis ionen kommer fra cellens omgivelser. Når calcium frigives fra denne tilstand, det er 'point of no return'. Dette er den mekanisme, der forklarer, at pumpen fungerer som en pumpe og ikke bare en passiv kanal. Denne virkelig unikke indsigt er baseret på meget avancerede eksperimenter. Disse eksperimenter gør os i stand til direkte at se pumpen udføre sit arbejde for første gang, "siger postdoktor Mateusz Dyla, den første forfatter til det nye papir.
Calciumpumpen har brug for energi, som den får ved at spalte et molekyle af ATP. Den frigivne energi omdannes til pumpens arbejde. Dette forklarer, hvordan store koncentrationsgradienter opbygges mellem indersiden og ydersiden af cellen. Koncentrationsforskellen kan være mere end 10, 000 gange, og denne store forskel er afgørende for kommunikationen mellem celler såsom i nervesignalering.
Røg og spejle
Grunden til, at eksperimenterne er så komplekse, er ret klar. Pumpen er så lille, at den ikke kan afbildes direkte i et lysmikroskop. Indtil nu, og med stort besvær, forskere har skabt molekylære modeller af pumpens stabile tilstande ved hjælp af en teknik kendt som røntgenkrystallografi. Dette er analogt med en stop-motion-film. Forskerne har i spøg omtalt deres visualisering af pumpens bevægelse mellem disse tilstande som 'Pump Fiction'. Den nye undersøgelse, som har været fem år undervejs, flytter visualiseringen fra stop-motion til levende billeder af pumpens funktionelle bevægelser. Tekniske forbedringer i mikroskopiske teknikker har gjort det muligt at observere den nye tilstand.
Teknikken er kendt som enkeltmolekyle fluorescensspektroskopi, og bruger et fænomen kendt som Förster resonansenergioverførsel, kort sagt FRET. Her, intenst laserlys og ultrafølsomme kameraer kombineres for at tillade direkte observation af et enkelt molekyle gennem den lille mængde lys, hvert molekyle udsender.
Forskergruppen har benyttet sig af en kalkpumpe fra bakterien Listeria, som blev forberedt til studierne gennem protein engineering. Konstruktionen af proteinet alene tog flere år at fuldføre.
I FRET-eksperimenterne, to farvestofmolekyler er knyttet til proteinet, som derefter oplyses af laserlys. Et farvestof, donoren, absorberer laserlyset og udsender det enten med en karakteristisk farve, eller alternativt overfører energien til det andet farvestof, acceptereren. Dette vil så udsende lys med en anden farve. Der vil således blive udsendt lys fra de to farvestoffer, og forskere kan måle afstanden mellem de to farvestoffer ved at måle, hvor meget lys der udsendes af hver farve. Fordi farvestofferne er blevet omhyggeligt indsat i to specifikke positioner i pumpen, disse afstandsændringer sporer pumpens pumpebevægelser.
Enkeltmolekyleteknikken muliggjorde de nye opdagelser, som forklaret af stipendiat Magnus Kjærgaard, Aarhus Institut for Avancerede Studier (AIAS), som også bidrog til opdagelsen.
"Vi er gået fra 'Pump Fiction' til 'Pump Live'. Tidligere, vi registrerede altid signalerne fra mange molekyler på samme tid, som slører bevægelserne. Ved at bruge enkelt-molekyle FRET-teknikker, vi kan fokusere på et molekyle ad gangen, som giver os mulighed for at observere de strukturelle ændringer direkte. Dette giver os en video af pumpen i aktion med færre huller. Vores Pump Fiction-film fik oprindeligt sit navn, fordi vi vidste, at overgangene mellem de forskellige tilstande i cyklussen var fiktive, og at der kunne gemme sig yderligere indsigt i hullerne mellem de kendte stater. Det har vi nu demonstreret i overflod, og afslørede samtidig kritisk ny indsigt i, hvordan pumpen fungerer, " han siger.
Udover at øge vores viden om livets grundlæggende processer, forståelsen af disse pumper kan også have praktiske anvendelser. Mutationer i pumperne kan forårsage defekter i hjerneceller, og dette kan forårsage neurologiske lidelser såsom migræne, midlertidig lammelse eller neurodegenerative lidelser.
Mekanismerne i disse ionpumper er således afgørende for at forstå fejlene i pumpen, især med henblik på at udvikle nye lægemidler målrettet pumpen.
"Vi er endnu ikke nået til det stadie, hvor vi kan overføre vores ionpumpeforskning til behandling af sygdom. den nye indsigt har ført til ideer, der kan bruges til at udvikle behandling af defekter i neuronal signalering, for eksempel. Men det her er arbejde for fremtiden. Lige nu, der er al mulig grund til at fejre åbenbaringen af de intime detaljer om et af livets vigtigste enzymer. Arbejdet har bygget på gode samarbejder her på universitetet, og med forskere i USA. Vi har allerede startet nye spændende samarbejder, der vil give os mulighed for at tage de næste skridt, siger professor Poul Nissen.
 Varme artikler
Varme artikler
-
 Forskere får et glimt af nanoskala af sprække- og grubetæring, mens det skerKredit:University of California - Santa Barbara Hvad påvirker næsten alt lavet af metal, fra biler til både til underjordiske rør og endda fyldninger i dine tænder? Korrosion - en langsom nedbrydn
Forskere får et glimt af nanoskala af sprække- og grubetæring, mens det skerKredit:University of California - Santa Barbara Hvad påvirker næsten alt lavet af metal, fra biler til både til underjordiske rør og endda fyldninger i dine tænder? Korrosion - en langsom nedbrydn -
 Fluorescensprobe viser fordelingen af aktive lithiumarter på lithiummetalanoderKredit:Wiley Batterier med metalliske lithium-anoder giver forbedret effektivitet sammenlignet med konventionelle lithium-ion-batterier på grund af deres højere kapacitet. Imidlertid, sikkerhedshe
Fluorescensprobe viser fordelingen af aktive lithiumarter på lithiummetalanoderKredit:Wiley Batterier med metalliske lithium-anoder giver forbedret effektivitet sammenlignet med konventionelle lithium-ion-batterier på grund af deres højere kapacitet. Imidlertid, sikkerhedshe -
 Biologisk sensor kan registrere glukoseniveauer i spyt mere præcist og omkostningseffektivt end blo…Forskere har udviklet en meget følsom, nøjagtig, fleksibel og overkommelig biologisk sensor, der kan registrere glukoseniveauer i spyt. Kredit:Hong Kong Polytechnic University Diabetes er en stofs
Biologisk sensor kan registrere glukoseniveauer i spyt mere præcist og omkostningseffektivt end blo…Forskere har udviklet en meget følsom, nøjagtig, fleksibel og overkommelig biologisk sensor, der kan registrere glukoseniveauer i spyt. Kredit:Hong Kong Polytechnic University Diabetes er en stofs -
 Første nogensinde in-situ måling af mekaniske egenskaber af hærdet cementmørtel på dybt havTil venstre:Måleapparat ved siden af cementmørtelprøve ved en vanddybde på ca. 3, 500 meter. Til højre:Fjernbetjent køretøj ROV Kaiko Mk-IV, bruges til at installere cementmørtelprøven. Kredit:JAMST
Første nogensinde in-situ måling af mekaniske egenskaber af hærdet cementmørtel på dybt havTil venstre:Måleapparat ved siden af cementmørtelprøve ved en vanddybde på ca. 3, 500 meter. Til højre:Fjernbetjent køretøj ROV Kaiko Mk-IV, bruges til at installere cementmørtelprøven. Kredit:JAMST
- Lavt uddannelsesniveau det tydeligste fællestræk bag betalingsmisligholdelse
- Kvinder kan bære hovedparten af klimaændringernes påvirkninger
- Hvordan livet (næppe) overlevede Jordens største udryddelsesbegivenhed
- Lyndata mere nyttige end tidligere antaget
- Hvad er eksplicit undervisning, og hvordan hjælper det børn med at lære?
- Forskere måler, hvor sød handlen er for virksomhedspolitiske donorer


