Hvorfor væske ikke har nogen bestemt form, men volumen?
* Intermolekylære kræfter: Dette er kræfterne til tiltrækning mellem molekyler. I væsker er disse kræfter svagere end i faste stoffer, men stærkere end i gasser.
* form: De svage intermolekylære kræfter i væsker giver molekyler mulighed for at glide forbi hinanden. Dette betyder, at væsken kan flyde og tage formen på dens beholder.
* bind: Molekylerne i en væske er relativt tæt sammen, hvilket skaber et fast volumen. Mens de kan bevæge sig rundt, kan de ikke komprimere meget, fordi de allerede er tæt pakket.
Her er en analogi:
Forestil dig en gruppe mennesker, der står tæt sammen i et rum. Hvis de holder hænderne (stærkere intermolekylære kræfter), kan de ikke bevæge sig frit og opretholde en stiv form (som et solidt). Hvis de bare står tæt på noget mellemrum mellem dem (svagere intermolekylære kræfter), kan de bevæge sig rundt og tage form af rummet (som en væske). Selvom de kan bevæge sig rundt, optager de dog stadig en vis plads (som et fast volumen).
Kortfattet:
* væsker har ingen bestemt form, fordi deres molekyler kan bevæge sig frit, så de kan tage formen på deres beholder.
* væsker har et bestemt volumen, fordi deres molekyler er tæt pakket og ikke kan komprimeres markant.
 Varme artikler
Varme artikler
-
 Skin et lys:Ny forskning viser, hvordan lavenergilys kan bøje plastikForskere afslørede en måde at bruge lavenergilys til at manipulere fotopolymerer eller plastfilm. Kredit:Florida State University Et hold af Florida State University-forskere har afsløret en måde a
Skin et lys:Ny forskning viser, hvordan lavenergilys kan bøje plastikForskere afslørede en måde at bruge lavenergilys til at manipulere fotopolymerer eller plastfilm. Kredit:Florida State University Et hold af Florida State University-forskere har afsløret en måde a -
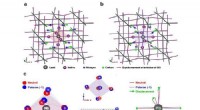 Skinner lys over spændingstilstande i perovskitmaterialerTeoretisk forudsagte strukturer af MAPbI 3 hybrid perovskit:en neutral klynge. b negativt ladet (polaron) klynge. c Forskellige perspektivlige sammenligninger af den neutrale (røde sfære) og polaron
Skinner lys over spændingstilstande i perovskitmaterialerTeoretisk forudsagte strukturer af MAPbI 3 hybrid perovskit:en neutral klynge. b negativt ladet (polaron) klynge. c Forskellige perspektivlige sammenligninger af den neutrale (røde sfære) og polaron -
 En katalysator, der ødelægger perklorat i vand, kan rense MarsjordKredit:CC0 Public Domain Ateam ledet af UC Riverside-ingeniører har udviklet en katalysator til at fjerne et farligt kemikalie fra vand på Jorden, der også kan gøre Marsjord mere sikker for landbr
En katalysator, der ødelægger perklorat i vand, kan rense MarsjordKredit:CC0 Public Domain Ateam ledet af UC Riverside-ingeniører har udviklet en katalysator til at fjerne et farligt kemikalie fra vand på Jorden, der også kan gøre Marsjord mere sikker for landbr -
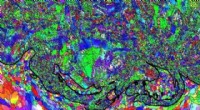 Løsningen på et forvirrende fænomen kan åbne døren til forbedret koldsprøjteeffektivitetDen øverste del viser en koldspray kobber belægning, med meget synlige hvirvellignende strukturer, der snurrer rundt om et aluminiumsunderlag i bunddelen. Kredit:EBSD Et internationalt forskerteam
Løsningen på et forvirrende fænomen kan åbne døren til forbedret koldsprøjteeffektivitetDen øverste del viser en koldspray kobber belægning, med meget synlige hvirvellignende strukturer, der snurrer rundt om et aluminiumsunderlag i bunddelen. Kredit:EBSD Et internationalt forskerteam
- Hvad er ændringen i hastighed pr. Enhedstid?
- Hvordan man skriver skelettækninger
- Hvilke dyr indeholder en masse mitokondrier?
- Hvorfor hedder alle Apollo-missionerne Apollo?
- Halvlederchip, der detekterer udåndet gas med høj følsomhed ved stuetemperatur
- Fra legeplads til bestyrelseslokaler:Hvordan barndom og ungdom former fremtidige ledere


