Hvad betyder for en fast masse ideel gas ved temperatur, produkttrykket og volumen er konstant gennemsnit?
for en fast masse ideel gas ved en konstant temperatur:
* fast masse: Vi har at gøre med en bestemt mængde gas og ikke tilføje eller fjerne nogen.
* Konstant temperatur: Gassen opvarmes eller afkøles ikke. Dens gennemsnitlige kinetiske energi forbliver den samme.
Produktet af tryk og volumen er konstant:
* tryk (p): Kraften, der udøves af gasmolekylerne på beholderens vægge.
* volumen (v): Rummet besat af gassen.
Boyle's lov siger, at hvis du øger presset på en fast gasmasse ved en konstant temperatur, vil volumenet falde proportionalt, og vice versa.
Hvorfor sker dette?
* Ideel gasantagelse: Boyle's lov gælder for ideelle gasser, som er teoretiske gasser med specifikke egenskaber. I en ideel gas antages molekylerne at have ubetydelig volumen og ingen intermolekylære kræfter.
* molekylære kollisioner: Presset af en gas opstår fra kollisionerne af dets molekyler med beholdervæggene.
* konstant kinetisk energi: Ved en konstant temperatur er den gennemsnitlige kinetiske energi af gasmolekylerne konstant. Dette betyder, at molekylerne rammer væggene med den samme gennemsnitlige kraft.
* Nedsat volumen =Forøgede kollisioner: Hvis du reducerer volumenet af beholderen, har gasmolekylerne mindre plads til at bevæge sig rundt. Dette betyder, at de kolliderer med væggene oftere, hvilket resulterer i et højere tryk.
Matematisk udtryk:
Boyle's lov udtrykkes matematisk som:
P₁v₁ =p₂v₂
Hvor:
* P₁ og V₁ er det oprindelige tryk og volumen
* P₂ og V₂ er det endelige pres og volumen
Virkelige applikationer:
Boyle's lov har mange praktiske applikationer, herunder:
* dykning: Dykkere skal være opmærksomme på, hvordan pres ændrer sig med dybden, hvilket påvirker luftmængden i deres tanke.
* motorer: Boyle's lov spiller en rolle i driften af forbrændingsmotorer, hvor komprimering af luft i cylinderen skaber højere tryk.
* Medicinsk udstyr: Boyle's lov bruges i medicinsk udstyr som sprøjter og åndedrætsværn.
Fortæl mig, hvis du gerne vil have en mere dybdegående forklaring af nogen af disse aspekter!
Sidste artikelHvilken proces bruger princippet fordampning og kondens?
Næste artikelHvorfor væske ikke har nogen bestemt form, men volumen?
 Varme artikler
Varme artikler
-
 Bioingeniører afslører overraskende sanse- og selvhelbredende evner hos kystvæsenerEn ramt skal, der har stået til reparation i 60 dage. Der er stadig tegn på tab af materiale fra spidsen, samt indre skader. Kredit:Professor David Taylor og Maeve ONeill, Trinity College Dublin.
Bioingeniører afslører overraskende sanse- og selvhelbredende evner hos kystvæsenerEn ramt skal, der har stået til reparation i 60 dage. Der er stadig tegn på tab af materiale fra spidsen, samt indre skader. Kredit:Professor David Taylor og Maeve ONeill, Trinity College Dublin. -
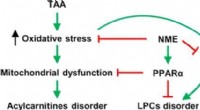 Muskatnødder skjult kraft:Hjælper leverenKredit:American Chemical Society Duftende muskatnød fremkalder billeder af efterår, græskartærte og varm æblecider. Men krydderiet er blevet brugt i årevis i traditionel kinesisk medicin til behan
Muskatnødder skjult kraft:Hjælper leverenKredit:American Chemical Society Duftende muskatnød fremkalder billeder af efterår, græskartærte og varm æblecider. Men krydderiet er blevet brugt i årevis i traditionel kinesisk medicin til behan -
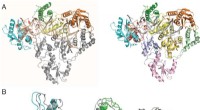 Forskning afslører strukturen af human endogen revers transkriptaseOversigt over HERV-K RT struktur. (A ) HERV-K RT med molA-underdomænerne farvet efter konvention og molB-underenheden farvet i gråt (Venstre ). Til højre , molA og molB er farvet af underdomæne. MolA:
Forskning afslører strukturen af human endogen revers transkriptaseOversigt over HERV-K RT struktur. (A ) HERV-K RT med molA-underdomænerne farvet efter konvention og molB-underenheden farvet i gråt (Venstre ). Til højre , molA og molB er farvet af underdomæne. MolA: -
 Video:Små formskiftende polymerer udviklet til potentielle medicinske anvendelserKredit:Unsplash/CC0 Public Domain Ingeniører hos Caltech har udviklet en proces til generering af tredimensionelle arkitekterede polymerer med varmeafhængige formhukommelses egenskaber:Det vil sig
Video:Små formskiftende polymerer udviklet til potentielle medicinske anvendelserKredit:Unsplash/CC0 Public Domain Ingeniører hos Caltech har udviklet en proces til generering af tredimensionelle arkitekterede polymerer med varmeafhængige formhukommelses egenskaber:Det vil sig
- Hvilken proces antydede bog, at organismer udvikler sig igennem?
- Beklager, jeg forstår ikke det:problemer med chatbots og hvordan man bruger dem bedre
- Hvordan angiver blade tilpasningen af træer i tempereret løvskov?
- Ny analyse af hjernens netværksaktivitet giver unik indsigt i epileptiske anfald
- Hvordan påvirker Moons -tyngdekraften din planet?
- Hvor kommer jord fra?


