Hvad er den kinetiske molekylære teori -partikelmodel af en gas?
1. Gasser består af små partikler. Disse partikler anses for at være punktmasser med ubetydelig volumen sammenlignet med rummet mellem dem. Dette er grunden til, at gasser er meget komprimerbare.
2. Partiklerne er i konstant tilfældig bevægelse. De bevæger sig i lige linjer, indtil de kolliderer med hinanden eller containervæggene. Kollisionerne er perfekt elastiske, hvilket betyder, at ingen energi går tabt under kollisionen.
3. Der er ingen attraktive eller frastødende kræfter mellem gaspartikler. Dette indebærer, at partiklerne bevæger sig uafhængigt af hinanden, undtagen under kollisioner.
4. Gaspartiklernes gennemsnitlige kinetiske energi er direkte proportional med den absolutte temperatur. Dette betyder, at når temperaturen øges, bevæger partiklerne sig hurtigere og har højere kinetisk energi.
5. Presset af en gas er forårsaget af kollisioner af gaspartiklerne med containerens vægge. Jo flere kollisioner, jo højere er presset.
implikationer af KMT -modellen:
* Gasudvidelse: Partiklerne er i konstant bevægelse og spreder sig for at fylde hele beholderen.
* gaskomprimerbarhed: De store rum mellem partikler giver mulighed for let komprimering.
* diffusion: Partikler af forskellige gasser blandes let på grund af deres tilfældige bevægelse.
* gastryk: Trykket opstår fra kollisioner af gaspartikler med containervæggene.
* Ideel gaslov: KMT -modellen giver et fundament for den ideelle gaslov, der vedrører tryk, volumen, temperatur og antallet af mol af en gas.
Begrænsninger af KMT -modellen:
* Ægte gasser afviger fra ideel opførsel ved høje tryk og lave temperaturer. Dette skyldes, at intermolekylære kræfter bliver betydelige under disse forhold.
* Modellen tegner sig ikke for de komplekse interaktioner mellem partikler, såsom van der Waals Forces.
På trods af sine begrænsninger er KMT -modellen et kraftfuldt værktøj til at forstå gassens opførsel og forklare en lang række fænomener.
Sidste artikelHvilket er et eksempel på noget opvarmet af ledning?
Næste artikelHvad er beta -partikler har et gebyr?
 Varme artikler
Varme artikler
-
 Brug af en porøs porphyrin til at genvinde ædle metaller fra elektronisk affaldPorøs porfyrinpolymer (COP-180) kan udvinde guld fra et computerkredsløb og producere rene guldklumper. Kredit:Yeongran Hong Et internationalt hold af forskere har brugt en porøs porphyrin til at
Brug af en porøs porphyrin til at genvinde ædle metaller fra elektronisk affaldPorøs porfyrinpolymer (COP-180) kan udvinde guld fra et computerkredsløb og producere rene guldklumper. Kredit:Yeongran Hong Et internationalt hold af forskere har brugt en porøs porphyrin til at -
 En ny metode til samtidig behandling af forskellige typer affaldKredit:CC0 Public Domain Et internationalt forskerhold er kommet med en innovativ metode til metalgenvinding fra industriaffald. Den nye metode tillader samtidig genvinding af flere metaller fra s
En ny metode til samtidig behandling af forskellige typer affaldKredit:CC0 Public Domain Et internationalt forskerhold er kommet med en innovativ metode til metalgenvinding fra industriaffald. Den nye metode tillader samtidig genvinding af flere metaller fra s -
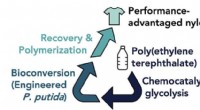 Forskere konstruerer mikroorganismer til at tackle PET-plastikforureningNREL- og ORNL-forskere har udviklet en metode til at opgradere PET til præstationsfordelagtig nylon, en forløber for andre værdifulde produkter såsom vandtæt tøj, stiftfri belægning af køkkengrej, og
Forskere konstruerer mikroorganismer til at tackle PET-plastikforureningNREL- og ORNL-forskere har udviklet en metode til at opgradere PET til præstationsfordelagtig nylon, en forløber for andre værdifulde produkter såsom vandtæt tøj, stiftfri belægning af køkkengrej, og -
 Ingeniører bygger kemisk drevne hjul, der skifter til gear for at udføre mekanisk arbejdeAnimation fra simulering, der demonstrerer rumlig-tidsmæssig kontrol af rotorer via en kaskadereaktion. GOx-belagt rotor (magenta) ligger på venstre side af kammeret, mens CAT-belagt rotor (grøn) ligg
Ingeniører bygger kemisk drevne hjul, der skifter til gear for at udføre mekanisk arbejdeAnimation fra simulering, der demonstrerer rumlig-tidsmæssig kontrol af rotorer via en kaskadereaktion. GOx-belagt rotor (magenta) ligger på venstre side af kammeret, mens CAT-belagt rotor (grøn) ligg
- Når du tænder for en ventilatorelektriske energi ændres til?
- Matematik kan forbedre influenzavaccinen, siger eksperter
- Hvad er en sætning for menneskelig miljøinteraktion?
- Undersøgelse giver detaljeret indsigt i de tidlige livsadfærd hos grå sælunger på havet
- Hvor mange vandatomer er der i brom?
- Mineteknikker til sand & grus


