Hvordan kan et atom blive elektrisk ladet?
* neutrale atomer: Et neutralt atom har et lige antal protoner (positivt ladede partikler) og elektroner (negativt ladede partikler). Denne balance resulterer i en nettoafgift på nul.
* At vinde elektroner: Når et atom får en eller flere elektroner, bliver det negativt ladet. Dette skyldes, at antallet af elektroner nu overstiger antallet af protoner. Disse negativt ladede atomer kaldes anioner .
* taber elektroner: Når et atom mister en eller flere elektroner, bliver det positivt ladet. Dette skyldes, at antallet af protoner nu overstiger antallet af elektroner. Disse positivt ladede atomer kaldes kationer .
Her er nogle eksempler:
* natrium (NA): Et neutralt natriumatom har 11 protoner og 11 elektroner. Det kan miste en elektron for at blive en natriumion (Na +) med en +1 ladning.
* klor (Cl): Et neutralt kloratom har 17 protoner og 17 elektroner. Det kan få et elektron til at blive en chloridion (CL-) med en -1 -ladning.
Faktorer, der påvirker ionisering:
* Elektrostatiske kræfter: Tiltrækningen mellem modsat ladede partikler kan få et atom til at vinde eller miste elektroner.
* Kemiske reaktioner: Kemiske reaktioner involverer ofte overførsel af elektroner mellem atomer, hvilket fører til dannelsen af ioner.
* varme og lys: Høje temperaturer eller eksponering for lys kan give energi til at fjerne elektroner fra atomer.
Betydningen af ioner:
Ioner spiller en afgørende rolle inden for mange områder inden for kemi, biologi og fysik. De er ansvarlige for:
* Kemisk binding: Ioner danner ioniske bindinger ved elektrostatisk tiltrækning.
* Elektrisk ledningsevne: Bevægelsen af ioner i opløsninger og faste stoffer muliggør strøm af elektricitet.
* Biologiske processer: Ioner er vigtige for nerveimpulser, muskelsammentrækninger og mange andre biologiske processer.
 Varme artikler
Varme artikler
-
 Nyt substrat til at hjælpe med at opdage mælkekontamineringKredit:Pixabay/CC0 Public Domain Forskere udvikler en ny og direkte tilgang baseret på overfladeforbedret Raman -spektroskopi (SERS) for at påvise antibiotika tetracyclin (TC) og pesticid dicyandi
Nyt substrat til at hjælpe med at opdage mælkekontamineringKredit:Pixabay/CC0 Public Domain Forskere udvikler en ny og direkte tilgang baseret på overfladeforbedret Raman -spektroskopi (SERS) for at påvise antibiotika tetracyclin (TC) og pesticid dicyandi -
 Filter kan være et match til fracking af vandEt superhydrofilt filter produceret på Rice University kan fjerne mere end 90 procent af forurenende stoffer fra vand, der bruges i hydrauliske fraktureringsoperationer. På dette billede, produceret v
Filter kan være et match til fracking af vandEt superhydrofilt filter produceret på Rice University kan fjerne mere end 90 procent af forurenende stoffer fra vand, der bruges i hydrauliske fraktureringsoperationer. På dette billede, produceret v -
 Forskere eliminerer lægemiddelbivirkninger ved at manipulere molekylær chiralitetDr. Jeffery Huang Zhifeng, Lektor ved Institut for Fysik ved HKBU, har udviklet en ny tilgang til at manipulere lægemiddelmolekylets chiralitet. Kredit:Hong Kong Baptist University Forskere fra Ho
Forskere eliminerer lægemiddelbivirkninger ved at manipulere molekylær chiralitetDr. Jeffery Huang Zhifeng, Lektor ved Institut for Fysik ved HKBU, har udviklet en ny tilgang til at manipulere lægemiddelmolekylets chiralitet. Kredit:Hong Kong Baptist University Forskere fra Ho -
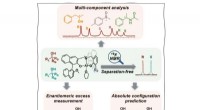 Fluor muliggør separationsfri chiral kromatografisk analyseMekanisme og hjælpeprogrammer i 19 F NMR-baseret separationsfri enantiodifferentiering. Kredit:Zhao Yanchun Forskere fra Shanghai Institute of Organic Chemistry fra det kinesiske videnskabsakade
Fluor muliggør separationsfri chiral kromatografisk analyseMekanisme og hjælpeprogrammer i 19 F NMR-baseret separationsfri enantiodifferentiering. Kredit:Zhao Yanchun Forskere fra Shanghai Institute of Organic Chemistry fra det kinesiske videnskabsakade
- Hvorfor kunne arrangementet af partikler i et fast materiale gøre det mere tæt end et andet fast s…
- At få nanoelektronik til at holde længere for medicinsk udstyr, cyborgs
- Topret i USA skal behandle nøglesag om Google-Oracle-software
- Når månen og solen er på modsatte sider af Jordens samme linje, hvad kan du så se?
- Betydningen af det 144 englenummer:Et tegn på åndelig opvågning og manifestation
- Kan energi overføres fra et objekt til et andet?


