Hvad er temperaturgasserne er ved nulvolumen?
* Ideel gaslov: Den ideelle gaslov (PV =NRT) beskriver forholdet mellem tryk (P), volumen (V), antal mol (N), temperatur (T) og den ideelle gaskonstant (R). Denne lov er en god tilnærmelse for mange gasser under normale forhold.
* Nulvolumen: En gas med nulvolumen ville betyde, at alle molekyler er pakket sammen uden plads mellem dem. Dette er umuligt, fordi molekyler har en endelig størrelse, og de afviser hinanden.
* når absolut nul: I henhold til den ideelle gaslov, hvis volumenet skulle falde til nul, ville temperaturen være nødt til at nå absolut nul (-273,15 ° C eller 0 kelvin). Dette er den teoretiske lavest mulige temperatur, hvor al molekylær bevægelse stopper.
Kortfattet:
* Det er umuligt for en gas at have nulvolumen i virkeligheden.
* Den ideelle gaslov forudsiger, at en gas med nulvolumen ville have en temperatur på absolut nul.
* At nå absolut nul er også umulig i praksis.
Det er vigtigt at huske, at den ideelle gaslov er en forenkling, og reelle gasser opfører sig ikke altid ideelt, især ved meget lave temperaturer eller høje tryk.
Sidste artikelHvilke temp er diamanter til gas?
Næste artikelHvilken slags dirigentmetal er?
 Varme artikler
Varme artikler
-
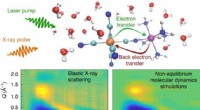 Forskere får indsigt i, hvordan opløsningsmiddelmolekyler påvirker lysdrevne reaktionerAbstrakt. Kredit: Naturkemi (2021). DOI:10.1038/s41557-020-00629-3 Lysabsorberende molekyler kan omdanne fotoner til elektricitet eller brændstoffer ved at skifte elektroner fra et atom til et an
Forskere får indsigt i, hvordan opløsningsmiddelmolekyler påvirker lysdrevne reaktionerAbstrakt. Kredit: Naturkemi (2021). DOI:10.1038/s41557-020-00629-3 Lysabsorberende molekyler kan omdanne fotoner til elektricitet eller brændstoffer ved at skifte elektroner fra et atom til et an -
 Ny metode mere end fordobler sukkerproduktionen fra planterBøgetræ under dekonstruktion. Kredit:Ydna Questell-Santiago (EPFL Laboratory of Sustainable and Catalytic Processing) Fremstilling af brændstoffer og kemikalier fra biomasse (træ, græsser, osv.) e
Ny metode mere end fordobler sukkerproduktionen fra planterBøgetræ under dekonstruktion. Kredit:Ydna Questell-Santiago (EPFL Laboratory of Sustainable and Catalytic Processing) Fremstilling af brændstoffer og kemikalier fra biomasse (træ, græsser, osv.) e -
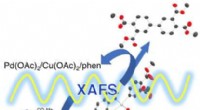 Synkrotronstråling kaster lys over dannelsesmekanismen for aromatisk polyimid-precursorSynkrotronstråling kaster lys over mekanismen for dehydrogenativ kobling af dimethylphthalat katalyseret af palladium- og kobberkomplekser. Kredit:Institut for Anvendt Kemi, Ingeniørskolen, Tokyo Univ
Synkrotronstråling kaster lys over dannelsesmekanismen for aromatisk polyimid-precursorSynkrotronstråling kaster lys over mekanismen for dehydrogenativ kobling af dimethylphthalat katalyseret af palladium- og kobberkomplekser. Kredit:Institut for Anvendt Kemi, Ingeniørskolen, Tokyo Univ -
 En selvhelbredende, vandafvisende belægning, der er ultra holdbarEn vanddråbe hopper af en hydrofob belægning på en overflade, der er blevet brændt og slidt i NCRC den 28. marts, 2017. Kredit:Joseph Xu/Multimedia Content Producer, University of Michigan - Engineeri
En selvhelbredende, vandafvisende belægning, der er ultra holdbarEn vanddråbe hopper af en hydrofob belægning på en overflade, der er blevet brændt og slidt i NCRC den 28. marts, 2017. Kredit:Joseph Xu/Multimedia Content Producer, University of Michigan - Engineeri
- Låser op for kvantepræcision:Udvidede superledende strimler for forbedret fotontællings nøjagtig…
- Mødrene er ikke i orden:Hvordan coronavirus-pandemipolitikker straffer mødre
- Hvordan tiltrækker hajer hjælpere?
- Hvorfor er fotosyntesen vigtig for mennesker?
- Hvorfor har regnskovgulvet ikke en høj frekvens af fotosyntesen?
- Hvad er uorganiske salte aflejret i organiske grundstoffer?


