Hvad er en ideel gas?
1. Ingen intermolekylære kræfter: Ideelle gaspartikler har ingen attraktive eller frastødende kræfter mellem dem. Dette betyder, at de bevæger sig uafhængigt af hinanden.
2. Ubetydelig mængde partikler: Volumenet, der er optaget af selve gaspartiklerne, betragtes som ubetydelig sammenlignet med den samlede volumen af beholderen.
3. Perfekte elastiske kollisioner: Kollisioner mellem gaspartikler og beholdervæggene er perfekt elastiske, hvilket betyder, at ingen energi går tabt under kollisioner.
4. Tilfældig bevægelse: Gaspartikler bevæger sig tilfældigt i alle retninger med en lang række hastigheder.
5. Gennemsnitlig kinetisk energi er proportional med temperaturen: Den gennemsnitlige kinetiske energi for gaspartiklerne er direkte proportional med den absolutte temperatur på gassen.
I virkeligheden er ingen gas perfekt ideel. Imidlertid opfører mange gasser ganske ideelt ved lave tryk og høje temperaturer. Dette skyldes, at de intermolekylære kræfter under disse forhold er svage, og partiklernes volumen bliver ubetydelig sammenlignet med beholderens volumen.
Hvorfor er begrebet en ideel gas vigtig?
* enkelhed: Den ideelle gasmodel forenkler studiet af gasser ved at fjerne kompleksiteten af intermolekylære kræfter og partikelvolumen.
* Matematisk bekvemmelighed: Den ideelle gaslov, der vedrører tryk, volumen, temperatur og antallet af mol af en ideel gas, er en enkel og nyttig ligning.
* God tilnærmelse: Den ideelle gasmodel giver en god tilnærmelse til opførsel af reelle gasser under visse betingelser.
Eksempler på ideel gasadfærd:
* helium (He): Helium, der er en ædel gas, har meget svage intermolekylære kræfter og lille atomstørrelse. Det opfører sig tæt på ideelt ved stuetemperatur og tryk.
* brint (H2): Hydrogen, et let molekyle, udviser også ideel gasadfærd under normale forhold.
Bemærk: Ægte gasser afviger fra ideel gasadfærd ved højt tryk eller lave temperaturer, hvor intermolekylære kræfter bliver mere markante. Denne afvigelse redegøres for af Van der Waals -ligningen.
Sidste artikelEr en plasticine -leder af varme?
Næste artikelHvad er tre ikke -eksempler af temperatur?
 Varme artikler
Varme artikler
-
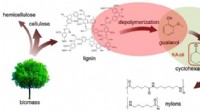 Ny proces gør papirfremstillingsaffald til værdifulde kemikalierKredit:Ames Laboratory En gruppe forskere ved U.S. Department of Energys Ames Laboratory har opdaget en måde at konvertere et fælles biprodukt af papirfremstillingsprocessen til værdifulde kemiske
Ny proces gør papirfremstillingsaffald til værdifulde kemikalierKredit:Ames Laboratory En gruppe forskere ved U.S. Department of Energys Ames Laboratory har opdaget en måde at konvertere et fælles biprodukt af papirfremstillingsprocessen til værdifulde kemiske -
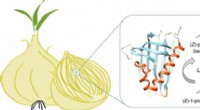 Den nitty-gritty bag hvordan løg får dig til at grædeKredit:American Chemical Society Tilføjelse af løg til en opskrift kan få et måltid til at smage rig og velsmagende, men at skære løget kan være brutalt. Løg frigiver en forbindelse kaldet lachrym
Den nitty-gritty bag hvordan løg får dig til at grædeKredit:American Chemical Society Tilføjelse af løg til en opskrift kan få et måltid til at smage rig og velsmagende, men at skære løget kan være brutalt. Løg frigiver en forbindelse kaldet lachrym -
 Retsmedicinsk analysemetode for læbestiftsspor udvikletKredit:Unsplash/CC0 Public Domain Retsmedicinere finder en ny måde at identificere mærker af læbestift på et gerningssted uden at fjerne beviser fra tasken. Ved hjælp af en teknik kaldet Raman -s
Retsmedicinsk analysemetode for læbestiftsspor udvikletKredit:Unsplash/CC0 Public Domain Retsmedicinere finder en ny måde at identificere mærker af læbestift på et gerningssted uden at fjerne beviser fra tasken. Ved hjælp af en teknik kaldet Raman -s -
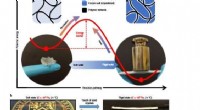 Et hybridmateriale, der skifter reversibelt mellem to stabile faste tilstande58 ° C). (c) Ved højt polymerindhold (P30L10), materialet er elastisk og fleksibelt, deformeres ved vridning, men vender tilbage til den oprindelige faste form, når kraften frigives. Ved lavt polymeri
Et hybridmateriale, der skifter reversibelt mellem to stabile faste tilstande58 ° C). (c) Ved højt polymerindhold (P30L10), materialet er elastisk og fleksibelt, deformeres ved vridning, men vender tilbage til den oprindelige faste form, når kraften frigives. Ved lavt polymeri
- Når du strækker en fjeder ud på hvilket tidspunkt ville have den største potentielle energi?
- Kan hastighed og acceleration pege i modsat retning?
- Har røde dværge og giganter lignende lysstyrke?
- Hvad er formålet med magma?
- Hvad er elementerne og forbindelserne i luft?
- Fald i atmosfærisk kuldioxid nøglen til gammel klimaovergang


