Hvilke reaktanter er i stand til at interagere for at danne produkter i en kemisk reaktion, der først skal overvinde termodynamisk barriere?
endotermiske reaktioner og termodynamiske barrierer
* Energiindgang: Endotermiske reaktioner kræver energiindgang fra omgivelserne. Denne energi bruges til at bryde eksisterende bindinger i reaktanterne, som er en energikrævende proces.
* entalpiændring: Enthalpyændringen (ΔH) for en endotermisk reaktion er positiv, hvilket betyder, at systemet absorberer varme fra omgivelserne.
* Aktiveringsenergi: For at indlede en endotermisk reaktion skal reaktanter overvinde en energibarriere kendt som Activation Energy (EA). Dette er den minimale mængde energi, der er nødvendig for reaktanterne til at nå en overgangstilstand, hvor der kan blive brudt obligationer og nye.
Eksempler på reaktanter i endotermiske reaktioner
* Nedbrydningsreaktioner:
* Opvarmning af calciumcarbonat (CACO3):
* CACO3 (S) + varme → Cao (S) + CO2 (G)
* Elektrolyse af vand:
* 2H2O (L) + Elektrisk energi → 2H2 (G) + O2 (G)
* reaktioner af metaloxider med syrer:
* reaktion af kobberoxid (CUO) med svovlsyre (H2SO4):
* CUO (S) + H2SO4 (AQ) + varme → CUSO4 (AQ) + H2O (L)
* Mange kemiske reaktioner, der involverer dannelsen af bindinger:
* dannelsen af nitrogendioxid (NO2) fra nitrogenmonoxid (NO) og ilt (O2):
* 2no (g) + o2 (g) + varme → 2no2 (g)
Nøglepunkter
* Aktiveringsenergi er en termodynamisk barriere, der skal overvindes, før en endotermisk reaktion kan fortsætte.
* varme er ofte den energikilde, der bruges til at tilvejebringe aktiveringsenergien.
* katalysatorer Kan sænke aktiveringsenergien, hvilket får reaktionen til at fortsætte hurtigere ved lavere temperaturer.
Fortæl mig, hvis du gerne vil have mere detaljerede forklaringer eller yderligere eksempler!
 Varme artikler
Varme artikler
-
 Kemikere forbedrer metoden til at udvinde naturlige antioxidanter fra laurbærbladeKredit:RUDN Universitet En kemiker fra RUDN Universitet og hans kolleger har foreslået at bruge rester fra forarbejdning af laurbærblade som råmateriale til fremstilling af kemisk aktive stoffer,
Kemikere forbedrer metoden til at udvinde naturlige antioxidanter fra laurbærbladeKredit:RUDN Universitet En kemiker fra RUDN Universitet og hans kolleger har foreslået at bruge rester fra forarbejdning af laurbærblade som råmateriale til fremstilling af kemisk aktive stoffer, -
 Højtydende multimetalliske kerne-mellemlag-shell-icosahedrale elektrokatalysatorer til ORRAktivitet og stabilitet af icosahedral AuPd@Pd@Pt elektrokatalysatorer for ORR sammenlignet med AuPd@Pt og kommercielle Pt/C elektrokatalysatorer. Kredit:Science China Press Protonudvekslingsmembr
Højtydende multimetalliske kerne-mellemlag-shell-icosahedrale elektrokatalysatorer til ORRAktivitet og stabilitet af icosahedral AuPd@Pd@Pt elektrokatalysatorer for ORR sammenlignet med AuPd@Pt og kommercielle Pt/C elektrokatalysatorer. Kredit:Science China Press Protonudvekslingsmembr -
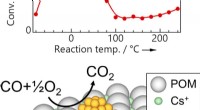 Ultraeffektiv fjernelse af kulilte ved hjælp af guld nanopartikler på en molekylær støtteNy katalysator bestående af guldnanopartikler understøttet på et Keggin-type polyoxometalat (POM) med et cæsiumsalt. Strukturen viste høj aktivitet og stabilitet for CO-oxidation; spormængder af vand
Ultraeffektiv fjernelse af kulilte ved hjælp af guld nanopartikler på en molekylær støtteNy katalysator bestående af guldnanopartikler understøttet på et Keggin-type polyoxometalat (POM) med et cæsiumsalt. Strukturen viste høj aktivitet og stabilitet for CO-oxidation; spormængder af vand -
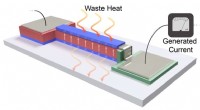 Tynd film omdanner varme fra elektronik til energiEn illustration af, hvordan tynd-film enhedssystemet omdanner spildvarme til energi. Kredit:Shishir Pandya Næsten 70 procent af den energi, der produceres i USA hvert år, går til spilde som varme.
Tynd film omdanner varme fra elektronik til energiEn illustration af, hvordan tynd-film enhedssystemet omdanner spildvarme til energi. Kredit:Shishir Pandya Næsten 70 procent af den energi, der produceres i USA hvert år, går til spilde som varme.
- Hvad kalder astronomer systemer med mere end 2 stjerner?
- Fra sårheling til regenerering
- Hvilken enhed omdanner den strålende energi til termisk energi?
- Hvad vil du observere på himlen, hvis månen vises over horisonten, før solen er gået under horis…
- US Postal Service lancerer test af selvkørende lastbiler
- Er online college noget for dig? Besvar fem spørgsmål for at finde ud af det


