Hvis 10 mol af en gas har måle tryk 2 atm og temperatur 200 K, hvad er dens volumen?
1. Forstå den ideelle gaslov:
Den ideelle gaslov er et grundlæggende forhold, der beskriver opførelsen af ideelle gasser. Det udtrykkes som:
* pv =nrt
Hvor:
* p er presset (i atmosfærer, ATM)
* v er lydstyrken (i liter, l)
* n er antallet af mol
* r er den ideelle gaskonstant (0,0821 l · atm/mol · k)
* t er temperaturen (i Kelvin, K)
2. Konverter målertryk til absolut tryk:
Målertryk måler trykket i forhold til atmosfærisk tryk. For at bruge den ideelle gaslov har vi brug for absolut pres.
* Forudsat at standard atmosfærisk tryk er 1 atm, er det absolutte pres:
* Absolutt tryk =målertryk + atmosfærisk tryk
* Absolutt pres =2 atm + 1 atm =3 atm
3. Tilslut værdierne og løs for volumen (v):
* P =3 atm
* n =10 mol
* R =0,0821 l · atm/mol · k
* T =200 k
Udskift disse værdier i den ideelle gaslovligning:
(3 atm) * V =(10 mol) * (0,0821 L · ATM/Mol · K) * (200 K)
Forenkle og løse for V:
V =(10 * 0,0821 * 200) / 3
V ≈ 54,73 L
Derfor er gassens volumen ca. 54,73 liter.
Sidste artikelHvordan adskiller kondensation og vapourisering sig?
Næste artikelDe fleste halogener danner forbindelser af hvad?
 Varme artikler
Varme artikler
-
 Fra laboratorium til plade:Gummibeton bøjer sig ind på boligmarkedetCirka 1,5 milliarder bildæk kasseres hvert år. Kredit:Pixabay/Berger-Team En ny tilgang til gummigenanvendelse kunne se udtjente dæk omdannet til beton til boligbyggerier, da ny forskning fra Unive
Fra laboratorium til plade:Gummibeton bøjer sig ind på boligmarkedetCirka 1,5 milliarder bildæk kasseres hvert år. Kredit:Pixabay/Berger-Team En ny tilgang til gummigenanvendelse kunne se udtjente dæk omdannet til beton til boligbyggerier, da ny forskning fra Unive -
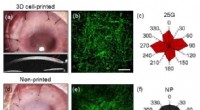 3D-trykte kunstige hornhinder ligner menneskeligeIn vivo (a-c) og in vitro (d-f) evalueringsresultater af 3D-celletrykte og ikke-trykte hornhindeimplantater. Optiske billeder fra spaltelampeundersøgelse, 2D tværsnits OCT-billeder (a, d), og SHG-bill
3D-trykte kunstige hornhinder ligner menneskeligeIn vivo (a-c) og in vitro (d-f) evalueringsresultater af 3D-celletrykte og ikke-trykte hornhindeimplantater. Optiske billeder fra spaltelampeundersøgelse, 2D tværsnits OCT-billeder (a, d), og SHG-bill -
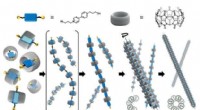 Selvsamlet kunstig mikrotubuli som LEGO byggeklodserHierarkisk selvsamling af polypseudorotaxaner til kunstige mikrotubuli. Kredit:Kimoon Kim (POSTECH) Simple LEGO klodser kan samles til mere komplicerede strukturer, som yderligere kan associeres t
Selvsamlet kunstig mikrotubuli som LEGO byggeklodserHierarkisk selvsamling af polypseudorotaxaner til kunstige mikrotubuli. Kredit:Kimoon Kim (POSTECH) Simple LEGO klodser kan samles til mere komplicerede strukturer, som yderligere kan associeres t -
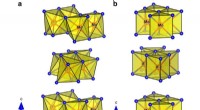 En ny metode til at udvinde brint fra vand mere effektivt for at opfange vedvarende energiKrystalstruktur og {MoTe}6 polyedre, der viser byggestenene i hver polymorf. en monoklinisk 1T′-MoTe2-fase og b hexagonal 2H-MoTe2-fase. Kredit: Naturkommunikation 10.1038/s41467-019-12831-0 En n
En ny metode til at udvinde brint fra vand mere effektivt for at opfange vedvarende energiKrystalstruktur og {MoTe}6 polyedre, der viser byggestenene i hver polymorf. en monoklinisk 1T′-MoTe2-fase og b hexagonal 2H-MoTe2-fase. Kredit: Naturkommunikation 10.1038/s41467-019-12831-0 En n
- Hvilken energiændring finder sted, når en kop falder af bordet?
- Hvorfor danner lipid -dobbeltlag spontant?
- Hvordan påvirker bicarbonater biotiske faktorer?
- Livet på Mars? Hollandsk selskab til at tilbyde envejsrejser den røde planet
- Hvordan er kræft og bevægelsesrelateret?
- Masseevakuering i Vietnam forud for supertyfonen Noru


