Hvad er forskellen mellem densitet af en gas og fast stof?
Densitet af faste stoffer:
* tæt pakket partikler: Partiklerne i et fast stof er tæt pakket sammen med meget lidt plads mellem dem.
* faste positioner: Partiklerne i en fast vibration på plads, men de bevæger sig ikke frit. Denne faste position bidrager til den høje densitet.
* Høj densitet: På grund af den tætte pakning og faste positioner har faste stoffer en høj densitet. Dette betyder, at de har en stor mængde masse pakket i et lille volumen.
Densitet af gasser:
* bredt fordelt partikler: Partiklerne i en gas er langt fra hinanden med en stor mængde plads mellem dem.
* fri bevægelighed: Gaspartikler bevæger sig tilfældigt i alle retninger og kolliderer med hinanden og containervæggene.
* lav densitet: Den store afstand mellem partikler gør gasser meget mindre tætte end faste stoffer. Dette betyder, at de har en lille mængde masse pakket i et stort volumen.
Her er en tabel, der opsummerer de vigtigste forskelle:
| Funktion | Solid | Gas |
| ----------------- | -------------- | --------------- |
| Partikelafstand | Tæt pakket | Bredt fordelt |
| Partikelbevægelse | Vibrerer på plads | Flyt tilfældigt |
| Densitet | Høj | Lav |
Ud over ovenstående:
* Kompressibilitet: Gasser er meget komprimerbare, hvilket betyder, at deres volumen let kan reduceres ved at anvende tryk. Faststoffer er meget mindre komprimerbare.
* form: Faststoffer har en fast form, mens gasser har formen på deres beholder.
Eksempler:
* fast: En jernblok er meget tæt.
* gas: Luft er en gas med en lav densitet.
Kortfattet: Forskellen i densitet mellem faste stoffer og gasser kommer fra den grundlæggende forskel i, hvordan deres partikler er arrangeret og bevæger sig. Denne forskel fører til en række andre kontrasterende egenskaber, såsom kompressibilitet og form.
 Varme artikler
Varme artikler
-
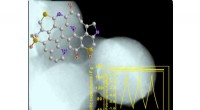 Højt nitrogen og svovl dobbelt-dopede kulstofmikrosfærer til superkondensatorerDenne figur viser morfologien, molekylær model og cyklisk ydeevne af den N/S co-doterede kulstofmikrosfære. Kredit:©Science China Press Blandt elektrodematerialer til superkondensatorer, kulstofba
Højt nitrogen og svovl dobbelt-dopede kulstofmikrosfærer til superkondensatorerDenne figur viser morfologien, molekylær model og cyklisk ydeevne af den N/S co-doterede kulstofmikrosfære. Kredit:©Science China Press Blandt elektrodematerialer til superkondensatorer, kulstofba -
 Forskere opdager, at molekyler spin flip fra magnetiske til ikke-magnetiske former dynamiskKredit:University of Missouri-Columbia En uventet opdagelse i professor Arthur Suits kemilaboratorium kunne få konsekvenser for fremstilling af mere effektive solceller og forbedring af fotodynami
Forskere opdager, at molekyler spin flip fra magnetiske til ikke-magnetiske former dynamiskKredit:University of Missouri-Columbia En uventet opdagelse i professor Arthur Suits kemilaboratorium kunne få konsekvenser for fremstilling af mere effektive solceller og forbedring af fotodynami -
 AI-agent hjælper med at identificere materialeegenskaber hurtigereKredit:CC0 Public Domain Effektiv analyse af røntgendiffraktionsdata (XRD) spiller en afgørende rolle i opdagelsen af nye materialer, for eksempel for fremtidens energisystemer. Det bruges til a
AI-agent hjælper med at identificere materialeegenskaber hurtigereKredit:CC0 Public Domain Effektiv analyse af røntgendiffraktionsdata (XRD) spiller en afgørende rolle i opdagelsen af nye materialer, for eksempel for fremtidens energisystemer. Det bruges til a -
 Forskere producerer en biocelle lige så effektiv som en platinbrændselscelleBiocelle, der bruger H2/O2-brændstof baseret på en varmestabil hydrogenase, der modstår ilt og et kulilte ved anoden og en varmestabil bilirubinoxidase ved katoden, der giver strømme i størrelsesorden
Forskere producerer en biocelle lige så effektiv som en platinbrændselscelleBiocelle, der bruger H2/O2-brændstof baseret på en varmestabil hydrogenase, der modstår ilt og et kulilte ved anoden og en varmestabil bilirubinoxidase ved katoden, der giver strømme i størrelsesorden


