Hvad sker der med molekyler, når et stof fordamper?
1. Øget kinetisk energi: Molekylerne i en væske bevæger sig konstant og kolliderer med hinanden. Når væsken opvarmes, absorberer molekylerne energi, og deres kinetiske energi øges. Denne øgede energi får molekylerne til at bevæge sig hurtigere og længere fra hinanden.
2. Breaking Intermolecular Bonds: Molekylerne i en væske holdes sammen af attraktive kræfter kaldet intermolekylære bindinger. Disse bindinger er svagere end de intramolekylære bindinger, der holder atomer sammen i et molekyle. Når molekylerne får energi, overvinder de disse intermolekylære kræfter og slipper fri fra den flydende overflade.
3. Overgang til gasfase: Når molekylerne slipper fri fra væsken, går de ind i gasfasen. I gasfasen er molekylerne langt længere fra hinanden og bevæger sig tilfældigt rundt. De er ikke længere bundet sammen af intermolekylære kræfter.
Kortfattet:
Fordampning er en faseændring hvor molekyler i en flydende forøgelse nok kinetisk energi til at overvinde intermolekylære kræfter og overgang til gasfasen. Dette resulterer i, at stoffet skifter fra en væske til en gas.
 Varme artikler
Varme artikler
-
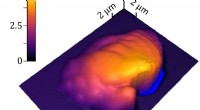 Ny metode måler 3-D polymerbearbejdning præcistEt 3D topografisk billede af en enkelt voxel af polymeriseret harpiks, omgivet af flydende harpiks. NIST-forskere brugte deres sample-coupled-resonance photo-rheology (SCRPR) teknik til at måle, hvord
Ny metode måler 3-D polymerbearbejdning præcistEt 3D topografisk billede af en enkelt voxel af polymeriseret harpiks, omgivet af flydende harpiks. NIST-forskere brugte deres sample-coupled-resonance photo-rheology (SCRPR) teknik til at måle, hvord -
 Massespektrometri kaster nyt lys over thalliumforgiftende cold caseHårprøver fra offeret monteres på objektglas til analyse ved massespektrometri. Kredit:Faye Levine I 1994, Den kinesiske universitetsstuderende Zhu Ling begyndte at opleve mavesmerter, hårtab og d
Massespektrometri kaster nyt lys over thalliumforgiftende cold caseHårprøver fra offeret monteres på objektglas til analyse ved massespektrometri. Kredit:Faye Levine I 1994, Den kinesiske universitetsstuderende Zhu Ling begyndte at opleve mavesmerter, hårtab og d -
 Ny teknologi kan tilbyde billigere, hurtigere mad testEn ny sikkerhedstest for fødevarebårne patogener er baseret på en ny type væskedråber, der kan binde til bakterielle proteiner. Denne interaktion, som kan detekteres med enten det blotte øje eller en
Ny teknologi kan tilbyde billigere, hurtigere mad testEn ny sikkerhedstest for fødevarebårne patogener er baseret på en ny type væskedråber, der kan binde til bakterielle proteiner. Denne interaktion, som kan detekteres med enten det blotte øje eller en -
 Ny katalytisk proces gør plastposer til limBrug af en katalysator baseret på ruthenium (guldkugle, centrum), UC Berkeley -kemikere var i stand til at tilføje specifikke kemiske grupper - i dette tilfælde, OH (rød) - til polyethylenpolymerkæder
Ny katalytisk proces gør plastposer til limBrug af en katalysator baseret på ruthenium (guldkugle, centrum), UC Berkeley -kemikere var i stand til at tilføje specifikke kemiske grupper - i dette tilfælde, OH (rød) - til polyethylenpolymerkæder
- Mikrobølger afslører detaljeret struktur af molekylær motor
- Hvordan man laver en beslutning ved marginen i økonomi
- Hvad er 55 Fahrenheit du grader?
- Hvilke faktorer påvirker hastigheden på en bølge?
- Hvad er en mekanisk fremdrivningsenhed?
- PITT-vej:Forskere opdager, hvordan celler reparerer et langtidsfremmende genbrugssystem


