PITT-vej:Forskere opdager, hvordan celler reparerer et langtidsfremmende genbrugssystem
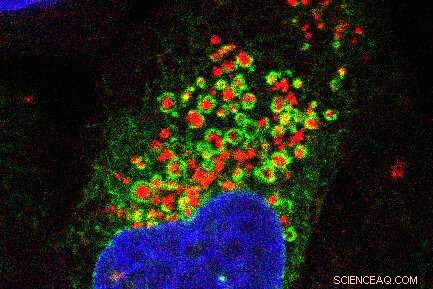
Fluorescensmikroskopibilleder, der viser det endoplasmatiske retikulum-netværk (grønt), der vikler sig rundt om beskadigede lysosomer (rødt). Cellekernen er vist med blåt. Kredit:Jay Xiaojun Tan
I dag i naturen , University of Pittsburgh forskere beskriver for første gang en vej, hvorved celler reparerer beskadigede lysosomer, strukturer, der bidrager til lang levetid ved at genbruge cellulært affald. Resultaterne er et vigtigt skridt i retning af at forstå og behandle aldersrelaterede sygdomme drevet af utætte lysosomer.
"Lysosombeskadigelse er et kendetegn for aldring og mange sygdomme, især neurodegenerative lidelser som Alzheimers," sagde hovedforfatter Jay Xiaojun Tan, Ph.D., assisterende professor i cellebiologi ved Pitt's School of Medicine og medlem af Aging Institute, en partnerskab mellem Pitt og UPMC. "Vores undersøgelse identificerer en række trin, som vi mener er en universel mekanisme til lysosomal reparation, som vi kaldte PITT-vejen som et nik til University of Pittsburgh."
Som cellens genbrugssystem indeholder lysosomer potente fordøjelsesenzymer, der nedbryder molekylært affald. Dette indhold er afskærmet fra at beskadige andre dele af cellen med en membran, der fungerer som et kædehegn omkring et farligt affaldsanlæg. Selvom der kan opstå brud i dette hegn, reparerer en sund celle hurtigt skaden. For at lære mere om denne reparationsproces gik Tan sammen med seniorforfatter Toren Finkel, M.D., Ph.D., direktør for Aging Institute og en fremtrædende professor i medicin ved Pitt's School of Medicine.
Først beskadigede Tan eksperimentelt lysosomer i laboratoriedyrkede celler og målte derefter de proteiner, der ankom til stedet. Han fandt ud af, at et enzym kaldet PI4K2A akkumulerede på beskadigede lysosomer inden for få minutter og genererede høje niveauer af et signalmolekyle kaldet PtdIns4P.
"PtdIns4P er som et rødt flag. Det fortæller cellen, 'Hej, vi har et problem her'," sagde Tan. "Dette alarmsystem rekrutterer derefter en anden gruppe proteiner kaldet ORP'er."
ORP-proteiner fungerer som tøjringer, forklarede Tan. Den ene ende af proteinet binder til det røde PtdIns4P-flag på lysosomet, og den anden ende binder til det endoplasmatiske retikulum, den cellulære struktur, der er involveret i syntese af proteiner og lipider.
"Det endoplasmatiske retikulum vikler sig rundt om lysosomet som et tæppe," tilføjede Finkel. "Normalt rører det endoplasmatiske retikulum og lysosomer næsten ikke hinanden, men når først lysosomet var beskadiget, fandt vi ud af, at de omfavnede."
Gennem denne omfavnelse transporteres kolesterol og et lipid kaldet phosphatidylserin til lysosomet og hjælper med at lappe huller i membranhegnet.
Phosphatidylserin aktiverer også et protein kaldet ATG2, der fungerer som en bro til at overføre andre lipider til lysosomet, det sidste membranreparationstrin i den nyligt beskrevne PITT-eller phosphoinositid-initierede membranbinding og lipidtransport-vej.
"Det smukke ved dette system er, at alle komponenterne i PITT-vejen var kendt for at eksistere, men de var ikke kendt for at interagere i denne sekvens eller for funktionen af lysosomreparation," sagde Finkel. "Jeg tror, at disse resultater vil have mange konsekvenser for normal aldring og for aldersrelaterede sygdomme."
Forskerne formoder, at hos raske mennesker bliver små brud i lysosommembranen hurtigt repareret gennem PITT-vejen. Men hvis skaden er for omfattende, eller reparationsvejen er kompromitteret - på grund af alder eller sygdom - akkumuleres utætte lysosomer. Ved Alzheimers er lækage af tau-fibriller fra beskadigede lysosomer et nøgletrin i sygdommens progression.
Da Tan slettede genet, der koder for det første enzym i pathwayen, PI4K2A, fandt han ud af, at spredningen af tau fibrill steg dramatisk, hvilket tyder på, at defekter i PITT-vejen kunne bidrage til Alzheimers sygdomsprogression. I det fremtidige arbejde planlægger forskerne at udvikle musemodeller for at forstå, om PITT-vejen kan beskytte mus mod at udvikle Alzheimers sygdom. + Udforsk yderligere
Forskere udfører metabolomisk profilering af individuelle forstørrede lysosomer
 Varme artikler
Varme artikler
-
 Californiens tørre områder er hotspots for plantediversitetGeraea canescens, Dødens dal. Kredit:Bruce Baldwin foto, Jepson Herbarium Slide Collection Den første big data analyse af Californiens oprindelige planter, ved hjælp af digitaliseret information f
Californiens tørre områder er hotspots for plantediversitetGeraea canescens, Dødens dal. Kredit:Bruce Baldwin foto, Jepson Herbarium Slide Collection Den første big data analyse af Californiens oprindelige planter, ved hjælp af digitaliseret information f -
 Hvad bruger kroppen kroppen nukleinsyrer til?Der er mange forskellige roller, som nukleinsyrer, der inkluderer DNA og RNA, spiller i den menneskelige krop og i andre levende organismer. Forskere identificerer fortsat regelmæssigt nye og forsk
Hvad bruger kroppen kroppen nukleinsyrer til?Der er mange forskellige roller, som nukleinsyrer, der inkluderer DNA og RNA, spiller i den menneskelige krop og i andre levende organismer. Forskere identificerer fortsat regelmæssigt nye og forsk -
 Parasitære planter er afhængige af usædvanlige metoder til at sprede deres frøFigur 1:(a) blomster af Yoania amagiensis, (b) blomster af Monopastrum humile, c) blomster af Phacellanthus tubiflorus, (d) frugt af Y. amagiensis, (e) frugt af M. humile, f) frugt af P. tubiflorus. K
Parasitære planter er afhængige af usædvanlige metoder til at sprede deres frøFigur 1:(a) blomster af Yoania amagiensis, (b) blomster af Monopastrum humile, c) blomster af Phacellanthus tubiflorus, (d) frugt af Y. amagiensis, (e) frugt af M. humile, f) frugt af P. tubiflorus. K -
 Simpel dyremodel afslører, hvordan miljø og tilstand er integreret for at kontrollere adfærdNeuronen AWA strækker sig fra ormens hjerne til dens næse. Kredit:Ian McLachlan/MIT Picower Institute Lad os sige, at du bor overfor et bageri. Nogle gange er du sulten og derfor fristet, når lugte
Simpel dyremodel afslører, hvordan miljø og tilstand er integreret for at kontrollere adfærdNeuronen AWA strækker sig fra ormens hjerne til dens næse. Kredit:Ian McLachlan/MIT Picower Institute Lad os sige, at du bor overfor et bageri. Nogle gange er du sulten og derfor fristet, når lugte
- NASA leder efter nye måder at håndtere affald på på dybe rummissioner
- Forsker diskuterer opdagelse af exoplaneter og hans særlige metode
- Sætter et spin på Heusler-legeringer
- Et computersystem i hukommelsen baseret på stablede 3D-resistive hukommelser
- Effekter af klimaændringer kan komplicere militærbasernes politik, undersøgelse finder
- Forskellen mellem søjlediagrammer og linjediagrammer


